
| A.金属腐蚀就是金属失去电子被还原的过程 |
| B.将需防腐的金属与外加直流电源的负极相连,正极与废铁相连 |
| C.镀锌铁皮发生腐蚀时,正极的电极反应式为:Fe-2e→ Fe2+ |
| D.铁钉在潮湿空气中生锈,是因为直接发生反应:4Fe+3O2→2Fe2O3 |
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:不详 题型:填空题
 ;
; 标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。
标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。

 s
s
 在如图构想的物质循环中太阳能最终转化为 能。
在如图构想的物质循环中太阳能最终转化为 能。
 (2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀 的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
的主要原因,某同学按右图进行钢铁腐蚀的模拟,则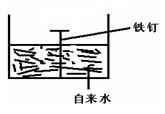

 极反应式为 ,
极反应式为 , 正极的电极反应式为 。
正极的电极反应式为 。 【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】
【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】 (3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图: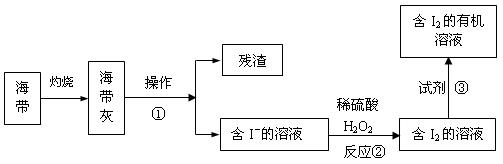

 操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
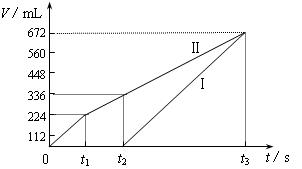
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
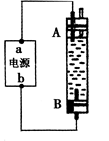
| A.如果用于制Fe(OH)2且装置中是氯化钠溶液,电源中“a”为正极,“ b”为负极 |
| B.如果用于制Fe(OH)2且装置中是氯化钠溶液,则A的电极材料应为铁,而B电极可用某一导电物质如石墨 |
| C.如果用于制漂白液,且装置中是氯化钠溶液,电源中“a”为正极,“ b”为负极 |
| D.如果用于制漂白液,且装置中是氯化钠溶液,电源中“b”电极材料一定不能为铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Zn2++2Br-,下列各反应:①Zn-2e-====Zn2+ ②Br2+2e-====2Br- ③2Br--2e-====Br2 ④Zn2++2e-====Zn,其中充电时的阳极和放电时的负极的反应分别是( )
Zn2++2Br-,下列各反应:①Zn-2e-====Zn2+ ②Br2+2e-====2Br- ③2Br--2e-====Br2 ④Zn2++2e-====Zn,其中充电时的阳极和放电时的负极的反应分别是( )| A.①② | B.③① | C.④② | D.③② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

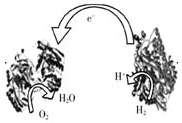
A.左边为该电池的正极 |
B.该电池可在高温环境下使用 |
C.该电池负极反应为:H2—2e-=2H+ |
D.该电池正极反应为O2+4e-=2O2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com