
(2002·济南)高岭土(主要成分是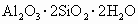 ,还含有少量
,还含有少量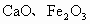 )可用来制取新型净水剂(铝的化合物).其步骤如下:将土样和纯碱混合均匀,加热熔融;冷却后用水浸取熔块并过滤,弃去残渣保留滤液;滤液用盐酸酸化,再经过分离,得沉淀和溶液,溶液即为净水剂.
)可用来制取新型净水剂(铝的化合物).其步骤如下:将土样和纯碱混合均匀,加热熔融;冷却后用水浸取熔块并过滤,弃去残渣保留滤液;滤液用盐酸酸化,再经过分离,得沉淀和溶液,溶液即为净水剂.
(1)写出熔融时主要成分(可看做氧化物)与纯碱反应的化学方程式__________________________________________.
(2)最后的沉淀物是________,生成该沉淀反应的方程式__________________________________.
(3)实验室常用的坩埚有瓷坩埚、氧化铝坩埚和铁坩埚.本实验中对土样和纯碱混合熔融时应使用________坩埚.
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
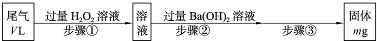
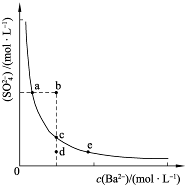
| O | 2- 4 |
| m×22.4 |
| 233V |
| m×22.4 |
| 233V |
查看答案和解析>>
科目:高中化学 来源: 题型:013
(2002·济南)将一定量的钠、铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用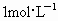 的盐酸滴定至沉淀量最大时,消耗盐酸40mL.原合金中钠的质量为
的盐酸滴定至沉淀量最大时,消耗盐酸40mL.原合金中钠的质量为
[ ]
查看答案和解析>>
科目:高中化学 来源: 题型:038
(2002·济南)常用的干燥剂硅胶,是网状多孔物质,主要成分为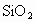 ,其中含水约为4%,制法是将硅酸在减压条件下加热到300℃使之分解.现有石英、纯碱、盐酸为原料,生产硅胶,试按生产顺序写出各步反应的化学方程式.
,其中含水约为4%,制法是将硅酸在减压条件下加热到300℃使之分解.现有石英、纯碱、盐酸为原料,生产硅胶,试按生产顺序写出各步反应的化学方程式.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com