
|
某二元酸 H2A在水溶液中发生电离:H2A | |
| [ ] | |
A. |
在 NaHA溶液中一定是c(Na+)>c(HA-)>c(OH-)>c(H+) |
B. |
在 Na2A溶液中一定是c(Na+)>c(A2-)>c(OH-)>c(H+) |
C. |
在 NaHA溶液中c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) |
D. |
在 H2A溶液中c(H+)=c(HA-)+2c(A2-)+c(OH-) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(14分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
A.溶液pH=7 B.水的离子积KW=c2(OH-) C.V=10 D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s) Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同).
②向浊液中通入HCl气体,c(Ca2+)________,原因是 .
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2+)= ____________mol/L
查看答案和解析>>
科目:高中化学 来源:2011-2012学年沈阳铁路实验中学高二上学期期末考试化学试卷 题型:填空题
(14分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 m ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
| A.溶液pH=7 | B.水的离子积KW=c2(OH-) | C.V=10 | D.c(K+)<c( Na+) Na+) |
 Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷 题型:填空题
(16分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-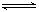 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 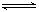 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。查看答案和解析>>
科目:高中化学 来源:2013届沈阳铁路实验中学高二上学期期末考试化学试卷 题型:填空题
(14分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
A.溶液pH=7 B.水的离子积KW=c2(OH-) C.V=10 D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)  Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同).
②向浊液中通入HCl气体,c(Ca2+)________,原因是 .
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2+)= ____________mol/L
查看答案和解析>>
科目:高中化学 来源:辽宁省期中题 题型:填空题
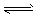 H++A2-,试回答下列问题:
H++A2-,试回答下列问题: Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com