
| A. | KClO3→KCl | B. | NH4+→N2 | C. | CO32-→CO2 | D. | Fe3+→Fe2+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时 体系能量的变化 | ||
| A | B | C | ||
| ① | 1 | 2 | 0 | 吸收热量:0.25akJ |
| ② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中C的体积分数均约为18% | |
| C. | 容器②中达到平衡时吸收的热量Q=0.25a kJ | |
| D. | 若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B形成的化合物为酸性氧化物 | |
| B. | 简单离子半径:D>B>C | |
| C. | 由这四种元素中的任意三种组成的无机盐溶于水均可促进水的电离 | |
| D. | 相同质量的C、D单质分别与足量的稀盐酸反应.前者生成的氢气更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
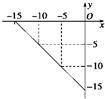 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com