
| 温度/°C | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |

 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:不详 题型:填空题
 下),理论上需通入乙醇 g?
下),理论上需通入乙醇 g?查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
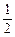 O2(g)=CO2(g) ΔH3<0 ③
O2(g)=CO2(g) ΔH3<0 ③ 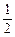 O2(g)=H2O(g) ΔH4<0 ④
O2(g)=H2O(g) ΔH4<0 ④查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.伴有能量变化的物质变化都是化学变化 |
| B.物质发生化学变化都伴随着能量变化 |
| C.化学反应中,反应物的总能量低于生成物的总能量 |
| D.化学反应中,反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应必然伴随能量变化 |
| B.25℃,101kPa下,l mol C8H18(辛烷)燃烧生成CO2和液态水时放出5518 kJ热量,其热化学方程式为:C8H18 (l)+12.5O2 (g)=8CO2 (g)+9H2O (l)△H=+5518kJ?mol-1 |
| C.酸和碱的中和反应都是放热反应 |
| D.反应物总能量高于生成物总能量,则该反应一定是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com