
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80g | |
| C. | 常温常压下,2.24L CO2和SO2混合气中氧原子数为0.2NA | |
| D. | 100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
分析 A.反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,生成1mol氧气转移2mol电子;
B.CuO和Cu2S中铜元素的质量分数相等,都是80%;
C.常温常压,Vm≠22.4L/mol;
D.溶液由溶质与溶剂组成,所含微粒指代不明确,无法计算.
解答 解:A.在H2O2+Cl2=2HCl+O2反应中,反应中只有氧元素的化合价升高由-1升高到0价,只有氯元素的化合价降低由0价降低到-1价,生成氧气的物质的量为$\frac{32g}{32g/mol}$=1mol,所以转移2NA个电子,故A错误;
B.80gCuO和Cu2S的混合物中含有铜元素的质量为:80g×$\frac{64}{80}$=64g,含有的铜的物质的量为1mol,含有铜原子数为NA,故B正确;
C.常温常压,Vm≠22.4L/mol,Vm未知,无法计算气体的物质的量,故C错误;
D.100mL0.1mol/L的NaCl溶液中,所含溶质离子总共为0.1L×0.1mol/L×2×NAmol-1=0.02NA,溶液由溶质与溶剂组成,还包含溶剂微粒,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的有关计算,明确物质的构成、发生的氧化还原反应、转移的电子数是解题关键,注意气体摩尔体积的条件应用,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)按系统命名法命 (1)有机物CH3CH(C2H5)CH(CH3)2的名称是2,3-二甲基戊烷.
(1)按系统命名法命 (1)有机物CH3CH(C2H5)CH(CH3)2的名称是2,3-二甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
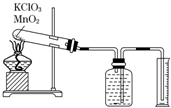 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
X、Y、Z、W、R属于短周期元素,已知它们都不是稀有气体元素,X原子半径是所属周期中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述中,错误的是
A. Y的最简单氢化物比R的稳定,Y的最简单氢化物沸点比R的高
B. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z
D. Y与Z两种元素组成常见ZY2型分子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com