
【题目】具有水果香味的中性物质A可以发生下列变化:
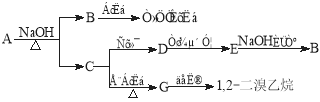
(1) 其中的弱酸是_____________________,G的结构简式为___________
(2) 写出下列变化的方程式:
A+NaOH→B+C的化学方程式:_____________________________________________
C→D的化学方程式:__________________________________________
D的银镜反应的离子方程式:_____________________________
【答案】(1)CH3COOH CH2=CH2 (2)CH3COOCH2CH3+NaOH![]() CH3COONa +CH3CH2OH
CH3COONa +CH3CH2OH
2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
CH3CHO+2Ag(NH3)2+2OH-![]() CH3COO-+NH4++3NH3+2Ag↓+ H2O
CH3COO-+NH4++3NH3+2Ag↓+ H2O
【解析】
试题分析:G与溴水反应生成1,2-二溴乙烷,则G是乙烯,C在浓硫酸的作用下生成乙烯,则C是乙醇。乙醇氧化生成乙醛,乙醛发生银镜反应生成醋酸铵,醋酸铵与氢氧化钠反应生成醋酸钠。醋酸钠酸化生成醋酸,所以A是乙酸乙酯。
(1)根据以上分析可知其中的弱酸是醋酸,G的结构简式为CH2=CH2。
(2) 根据以上分析可知A+NaOH→B+C的化学方程式为CH3COOCH2CH3+NaOH![]() CH3COONa +CH3CH2OH ;C→D的化学方程式为2CH3CH2OH+O2
CH3COONa +CH3CH2OH ;C→D的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。D的银镜反应的离子方程式为CH3CHO+2Ag(NH3)2+2OH-
2CH3CHO+2H2O。D的银镜反应的离子方程式为CH3CHO+2Ag(NH3)2+2OH-![]() CH3COO-+NH4++3NH3+2Ag↓+ H2O。
CH3COO-+NH4++3NH3+2Ag↓+ H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的固体物质,只需加水就可以鉴别的一组是
A. CaCO3、BaSO4、Na2CO3 B. CuSO4、NaCl、NaCO3
C. NaCl、CuSO4、CaCO3 D. NaCl、KNO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A.CH3CH2CH=CHCH2CH3不存在顺反异构体。
B.分子式为C5H10O2的羧酸有8种
C.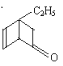 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
D.棱晶烷![]() 为正三棱柱形,它的二氯代物有5种
为正三棱柱形,它的二氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是( )。
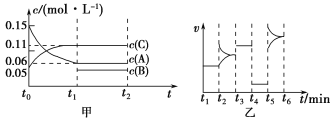
A.若t1=15 s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) ![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为:
![]()
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.υ正(CO)=υ逆(H2)
d.c (CO) = c (H2) e、υ(H2O):υ(CO):υ(H2)=1:1:1
(2) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2 (g)+H2 (g) ,得到如下三组数据:
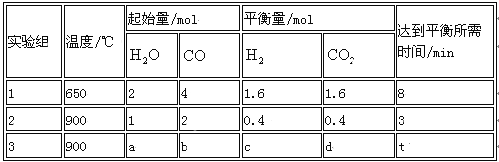
① 实验1中从开始到达平衡时CO表示反应的平均速率为 mol/(l·min),CO(g)的转化率为 。
② 实验2中H2O(g)的转化率为 ,该反应的逆反应为_______ (填“吸”或“放”)热反应。
③ 若实验3平衡时要达到与实验2中平衡时各物质的质量分数分别相等,且t<3min,则a、b应满足的关系 是______________ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2 (g)+3H2 (g) CH3OH(g)+H2O(g)图(1)表示该反应进行过程中能量(单位为kJmol-1。)的变化。
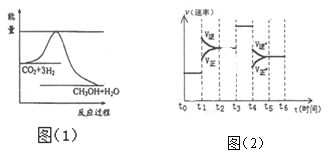
① 在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是_______ (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3 molH2
② 当反应达到平衡时不断改变一个条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图(2): 其中表示平衡混合物中CH3OH含量最高的一段时间是_______ ;t1~t2改变的条件为 若t0~t1平衡常数为K1, t2~t3平衡常数为K2 ,则K1 _______K2 (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是( )
A.H3PO2溶于水的电离方程式为:H3PO2![]() H++H2PO2-
H++H2PO2-
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4
D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式。
_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com