
����Ŀ����ij������Һ��ͨ��������������������������������Һ��ͨ�����CO2 �� ����������ɫ������
��1��д�������ĵ���ʽ��
��2����������Һ��һ�������ܺ������������������ţ���
A.Cl��
B.Fe2+
C.SiO32��
D.AlO2��
��3��д��һ��ͨ�����CO2ʱ���ɰ�ɫ���������ӷ���ʽ��
��4����ƹ�ҵ�����������������ж���ˮ�������ϸ�����ſ����ŷţ�ij�ָ�Ũ���ж��ĺ�A���ӣ������ӣ���ˮ���ŷ�ǰ�Ĵ����������£�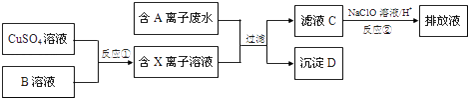
��֪��9.0g����D�����������պ���8.0g��ɫ���壬��Ӧ�������ͨ����������ʯ��ˮʱ������10.0g��ɫ���������õ��Ļ�������ȥ������ʣ�������ܶ�Ϊ1.25g/L������1.12L��
����D�Ļ�ѧʽ����
��5��д������D�����������շ����Ļ�ѧ����ʽ��
��6����ҺC�л���������A���ӣ�ͨ����Ӧ�ڣ��ɽ���ת��Ϊ�Ի����������ʣ��������ӷ���ʽ��ʾ��ԭ����
��7����Ӧ��Ϊ�Ƶ�ij��Ԫ�صĵͼ�X���ӣ���������ԭ��Ӧ�ĽǶȷ���������ܡ����ܡ���Na2SO3��Һ������B��Һ��ԭ������
��8�����ʵ��֤������Na2SO3��Һ�Ƿ������
���𰸡�
��1��![]()
��2��B
��3��CO2+AlO2��+2H2O=Al��OH��3��+HCO3��
��4��CuCN
��5��2CuCN+3O2 ![]() 2CuO+N2+2CO2
2CuO+N2+2CO2
��6��2CN��+5ClO��+2H+=5Cl��+N2��+2CO2��+H2O
��7���ܣ���ΪNa2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ��������������𰸣�
��8��ȡ����Na2SO3��Һ���Թ��У���������ϡ���ᣬ�ټ����Ȼ�����Һ�����г������ɣ�˵��Na2SO3��Һ���ʣ�����˵��Na2SO3��Һδ���ʡ�
����������1�������ǹ��ۻ��������ʽΪ ![]() ��
��
��2��A��Cl���Է�Ӧ��Ӱ�죬���ܴ��ڣ�B������Fe2+����Һ��ͨ���������������ɳ�����B�����ܴ��ڣ�C������SiO32������Һ��ͨ�백����������������ͨ�����CO2 �� ���ɹ�����������ܣ�D������AlO2������Һ��ͨ�백����������������ͨ�����CO2 �� ���������������������ܣ���ѡB��
��3�����ݣ�2���ķ�������ɫ���������ǹ��������������������Ӧ�����ӷ���ʽΪCO2+AlO2��+2H2O=Al��OH��3��+HCO3����2CO2+SiO32��+2H2O=H2SiO3��+2HCO3����
��4����������ͼ������D�к���CuԪ�أ�8.0g��ɫ����Ϊ0.1molCuO������Cu 6.4g�����ɵ�����ͨ����������ʯ��ˮ������10.0g��ɫ������˵����ɫ������̼��ƣ�����0.1molCO2 �� C������Ϊ1.2g��ʣ��������ܶ�Ϊ1.25g/L��˵����Է�������Ϊ1.25g/L��22.4L/mol=28g/mol���������Ӧ��ΪN2 �� N2�����Ϊ1.12L�����ʵ���Ϊ0.05mol������N1.4g����Ϊ6.4g+1.2g+1.4g=9.0g����ʾ������ֻ��������Ԫ�أ������ʵ���Ϊ1:1:1����˳���D�Ļ�ѧʽΪCuCN��
��5�����ݣ�2���ķ�����CuCN����������������CuO ��CO2 ��N2����Ӧ�ķ���ʽΪ2CuCN+3O2 ![]() 2CuO+2CO2+N2��
2CuO+2CO2+N2��
��6������D�Ļ�ѧʽΪCuCN��˵��A����ΪCN- �� NaClO��Һ���������ԣ���CN����������CO2 ��N2 �� ��������ԭΪ�Ȼ��ƣ���Ӧ�����ӷ���ʽΪ2CN��+5ClO��+2H��=5Cl��+2CO2��+N2��+H2O��
��7����Ӧ��Ϊ�Ƶ�ij��Ԫ�صĵͼ�X����ΪCu+ �� ������Cu2+�������ԣ�Na2SO3��S��+4�ۣ����н�ǿ�Ļ�ԭ�ԣ�������Na2SO3 ��Һ������B��Һ��Na2SO3 ��Һ������ʣ������������ƣ�ֻҪ�����Ƿ�����������Ӽ��ɣ����Է���Ϊȡ����Na2SO3��Һ���ȼ���BaCl2��Һ���ټ�������ϡ���ᣬ�۲������������У�˵��Na2SO3��Һ�ѱ��ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵������������������(��״��)֮��Ĺ�ϵ��ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ����(����)
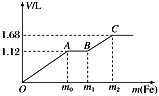
A. ��ʼʱ����������ΪH2
B. AB�η����ķ�ӦΪ�û���Ӧ
C. ���û����Һ��c(HNO3)��0.5 mol��L��1
D. �μӷ�Ӧ���۵�������m2��8.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������淋���������ͼ��ʾ��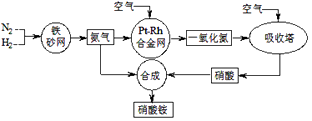
��1������淋�ˮ��Һ��(����ԡ��������ԡ����ԡ�)����ˮ��Һ�и����ӵ�Ũ�ȴ�С˳��Ϊ����
��2����֪N2(g)+3H2(g) ![]() 2NH3(g) ��H<0������Ӧ���а�n(N2)��n(H2)=1��3Ͷ�ϣ��ֱ���200�桢400�桢600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯��������ͼ��
2NH3(g) ��H<0������Ӧ���а�n(N2)��n(H2)=1��3Ͷ�ϣ��ֱ���200�桢400�桢600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯��������ͼ��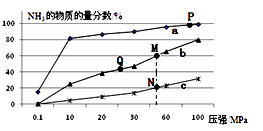
������a��Ӧ���¶�����
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ������
A����ʱ�����NH3�������H2��ƽ��ת����
B��P��ԭ������ƽ��ת���ʽӽ�100%���ǵ�ǰ��ҵ���������в��õ��¶ȡ�ѹǿ����
C����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)=K(Q)��K(N)
D�����N��ʱc(NH3)��0.2 mol��L��1 �� N��Ļ�ѧƽ�ⳣ��K��0.93
��3�����أ�H2NCONH2����һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3(g)��CO2(g)=H2NCOONH4(s) ��H=��272 kJ��mol��1
�ڶ�����H2NCOONH4(s)=CO(NH2)2(s)��H2O(g) ��H=��138 kJ��mol��1
д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��
��4��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯������ͼ��ʾ��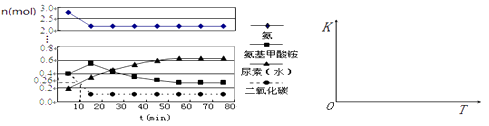
����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ�����Ӧ�������ܷ�Ӧ���е�minʱ����ƽ�⡣
�ڷ�Ӧ���е�10 minʱ���CO2�����ʵ�����ͼ��ʾ������CO2��ʾ�ĵ�һ����Ӧ������v(CO2)�� ��
����������ͼ�л����ڶ�����Ӧ��ƽ�ⳣ��K���¶ȵı仯��ʾ��ͼ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�Ӧ��1��2Fe3++Cu��Cu2++2Fe2+ ��2��2Fe2++Cl2��2Fe3++2Cl����3��HClO + H+ + Cl����H2O+Cl2�������жϳ������ӵ���������ǿ����˳����ȷ����
A. HClO> Cl2> Fe3+> Cu2+ B. Cl2>HClO>Fe3+>Cu2+
C. Cl2>Fe3+>HClO>Cu2+ D. HClO>Cl2>Cu2+>Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ����仯ʱ�����˷������Ӽ���������ڷ��Ӽ����������ǣ�������
A.�ƾ����ȱ�Ϊ����
B.�Ȼ�����ȱ�Ϊ����
C.�������������ۻ�
D.ʳ���ܽ���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������pH��Ϊ3��HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpHֵ�ı仯����ͼ��ʾ������˵����ȷ���ǣ� ��
A.��HB��Һ�еμ�NaOH��Һ�Ĺ����У�ˮ�ĵ���̶�һֱ����
B.��pHΪ11��ij����pHΪ3��HB��Һ�������Ϻ���Һ�������Լ���
C.��ˮ��HA��Һ��Ϻ����Һ�п��ܴ��ڣ�c(NH4�� )>c(A��)>c(H��)>c(OH��)
D.��ȫ�к͵������pH��HA��HB����Һʱ������ͬŨ��NaOH��Һ�������HA<HB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��W��Ϊ��ѧ�����Ĵ��������֮��������ת����ϵ���������P��Ӧ��������ȥ����Ӧ������ˮ��Һ�н��У���
![]()
(1)��A��B��C�������ʵ���Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��C���ȷֽ��ת��ΪB
����W�Ļ�ѧʽΪ____��B�Ļ�ѧʽ____��
��A��Һ��C��Һ��Ӧ�Ļ�ѧ����ʽΪ____��
(2)��AΪ����ɫ����,WΪ�������ʣ�B����Һ��KSCN�Ժ�ɫ��
��B��Wת��ΪC�����ӷ�Ӧ����ʽ___��
��C��Aת��ΪB�����ӷ�Ӧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǹ��������Ļ������ʣ��ڼ������߲ˡ������͵�ʳ���У����������ʵ��� �� ��84����Һ�����ճ������б��㷺ʹ�ã�������Һ��ɫ����ijЩ��ɫ���ʾ���Ư�����ã�������Ч�ɷ������KMnO4����NaClO������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com