
| A、硝酸 | B、乙醇 |
| C、少量硝酸和硝酸银混合溶液 | D、盐酸 |


科目:高中化学 来源: 题型:
| A、电池的总反应是:2CH3OH+3O2=2CO2+4H2O |
| B、正极的反应为:O2+4H++4e-=2H2O |
| C、负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+ |
| D、电池工作时,H+由正极移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同质量、不同密度的N2和C2H4 |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的CO和N2 |
| D、同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从1L 1mol/L的NaCl溶液中取出 10mL,其浓度仍是1mol/L |
| B、制成0.5 L 10 mol/L的盐酸,而要氯化氢气体112 L(标准状况) |
| C、0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10g 98%的硫酸(密度为1.84 g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c[Cu(NH3
| ||
| c(Cu2+)?c4(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
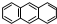 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(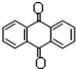 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com