
【题目】A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,相互转化关系如图所示(条件已略去)。完成下列问题:

(1)若A为淡黄色固体,B为气体,F为非金属单质。
①写出E转变为C的化学方程式________________________________。
②B在空气中能使银器表面失去金属光泽、逐渐变黑,该反应的氧化剂和还原剂之比为_____。
(2)若B为能使湿润的红色石蕊试纸变蓝的气体。
①B和E反应得到的产物中所含的化学键类型为____________________。
②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为___________________。
③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式______。
【答案】C+2H2SO4(浓) △ CO2↑ +2SO2↑+2H2O 1:4 离子键、共价键 Ag+4H++NO3-=3Ag+ +NO↑+2H2O 4AgNO3+2Cl2=2N2O5+O2+4AgCl↓
【解析】
(1)若A为淡黄色固体,则A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,F为C;
(2)若B为能使湿润的红色石蕊试纸变蓝的气体,为NH3,则A为N2,C为NO,D为NO2,E为HNO3,F为C。
(1)经分析,A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,F为C,则:
① 浓硫酸和碳反应生成二氧化碳和二氧化硫和水,方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
②B在空气中能使银器表面失去金属光泽、逐渐变黑,方程式为2H2S+O2+4Ag=2Ag2S+2H2O,反应中氧化剂为氧气,还原剂为银,二者物质的量比为1:4;
(2) 经分析,A为N2,B为NH3,C为NO,D为NO2,E为HNO3,F为C,则:
①氨气和硝酸反应生成硝酸铵,含有离子键、共价键;
②银和硝酸反应生成硝酸银和一氧化氮和水,离子方程式为:Ag+4H++NO3- =3Ag+ +NO↑+2H2O;
③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,氯气化合价降低,氮元素化合价不变,则气体单质为氧气,方程式为:4AgNO3+2Cl2=2N2O5+O2+4AgCl↓。


科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时发生的反应为:4VB2+11O2=4B2O3+2V2O5。下列说法不正确的是( )
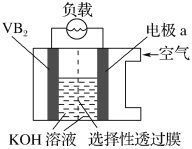
A.电极a为电池正极
B.电池工作过程中,电极a附近区域pH减小
C.图中选择性透过膜为阴离子透过膜
D.VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池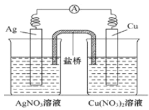 。以下有关该原电池的叙述正确的是( )
。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:____________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下2.24L O2时,转移电子为______ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在其水溶液中的电离方程式:______。(只写第一步)
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确:___________
Ⅱ.工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
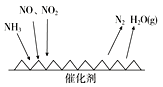
(1)由上图可知SCR技术中的氧化剂为________。
(2)用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________________________________
Ⅲ.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4 kJ/mol
2CH3OH(g) △H2= +23.4 kJ/mol
反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
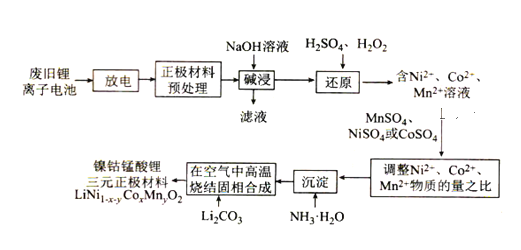
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是___。
(2)能够提高“碱浸”效率的方法有___(至少写两种)。
(3)“碱浸”过程中,铝溶解,在该反应中每产生1mol非极性共价键放出133.3kJ的热量,请写出该反应的热化学方程式___。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:___。
(5)LiCoO2参与“还原”反应的离子方程式为___。在该反应中H2O2做___(氧化剂,还原剂)1molH2O2参与反应转移__ NA个电子
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是___。
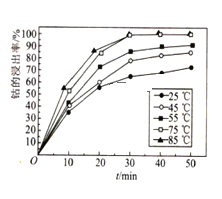
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为____(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6、⑥CH3CH=CH2中,一定互为同系物的是_______,一定互为同分异构体的是________________(填编号);
(2)以五倍子为原料可制得A,A结构简式为下图所示,回答下列问题:
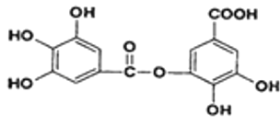
①A的分子式为______________;
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为_____ ;
(3)写出含有1个-CH2-、1个![]() 、3个-CH3原子团的烃类物质的结构简式___________;
、3个-CH3原子团的烃类物质的结构简式___________;
(4)写出核磁共振氢谱有两组峰,且峰面积之比为3:2,分子式为C8H10的芳香烃类化合物的结构简式_________;
(5)写出该有机物的名称![]() ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)写出对应元素的名称:A_____,C_____,E_____。
(2)写出下列物质的电子式:
①D元素形成的单质____;②A、B、E形成的化合物____;③D、E形成的化合物______。
(3)A和B可形成A2B、A2B2两种化合物,E与B可形成E2B、E2B2两种化合物,则下列说法不正确的是_____。
A.A2B2和E2B2中都含有非极性共价键
B.A2B和E2B都含离子键
C.A2B和A2B2中阴阳离子个数比均为1∶2
D.A2B和A2B2均能溶于E2B,并发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com