
����Ŀ��ʯ��β����Ҫ����Mg3(Si2O5)(OH)��������Fe2O3��Al2O3����ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)�Ĺ�����ͼ��
��֪�������������е�����ӦΪ��Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3��+2SiO2+7H2O��+2SO3��
3MgSO4+10NH3��+2SiO2+7H2O��+2SO3��
��1��д�����ղ���NH3�ĵ���ʽ__��
��2��Ϊ���ˮ�����ʣ��ɲ�ȡ�Ĵ�ʩΪ__����дһ�����ɣ���������������Ҫ�ɷ�Ϊ___��
��3����������pH������ʱ����ȥ������������__�������£���Ҫ����Һ�е�c(Fe3+)������4.0��10-11mol/L����Ӧ������Һ��pH=___��Ksp[Fe(OH)3]=4.0��10-38����
��������pH������ʱ������ѡ�õ��Լ���___��
A��MgO B��NaOH C��MgCO3 D��HNO3
��4������þ�������з�Ӧ�����ӷ���ʽΪ___������þ��ʱ���¶ȳ���60�棬�������϶�ļ�ʽ̼��þ[Mg2(OH)2CO3]���ʣ�ԭ����__��
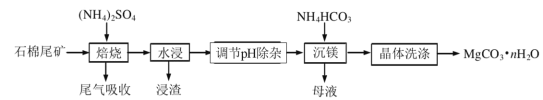
��5��ijС��ͬѧ��ȡ15.6gMgCO3��nH2O�������ط�����������ʣ������������¶ȱ仯��������ͼ��ʾ����n=__��
���𰸡�![]() �����պ����ù���������Ȼ���� SiO2 Fe3+��Al3+ 5 AC Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�� ���´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩ 4
�����պ����ù���������Ȼ���� SiO2 Fe3+��Al3+ 5 AC Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�� ���´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩ 4
��������
��ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)��ע����������Ҫ��ȥ���ʣ���������Fe2O3��Al2O3��
��1��Nԭ���������5�����ӣ���3��Hԭ�ӹ��õ��ӹ����ȶ���8���ӽṹ���� NH3�ĵ���ʽ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��Ϊ���ˮ�����ʣ��ɽ�������������߽��������������Һ��ĽӴ�������ʵ�����Ҳ�������ˮ�����ʣ��ʴ�Ϊ�������պ����ù���������Ȼ���裻������Ϣ��������ʱ����ӦΪ��Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3��+2SiO2+7H2O��+2SO3����
3MgSO4+10NH3��+2SiO2+7H2O��+2SO3����
������ֻ��SiO2������ˮ����Ϊ��������ȥ���ʴ�Ϊ��SiO2��
��3���ٱ����̵�Ŀ���ǣ�ʯ��β��ΪþԴ�Ʊ�̼��þ����(MgCO3��nH2O)��ˮ������Һ�д��ڵ�����������Fe3+��Al3+ ����Ҫ����pH���ӣ��ʴ�Ϊ��Fe3+��Al3+��
�����£���Ҫ����Һ�е�c(Fe3+)������4.0��10-11mol/L������ Ksp[Fe(OH)3]=4.0��10-38��֪Ksp[Fe(OH)3]= ![]() ���������ݣ����c(OH-)=1.0��10-9mol��L
���������ݣ����c(OH-)=1.0��10-9mol��L![]() ��c(H+)=1.0��10-9mol��L
��c(H+)=1.0��10-9mol��L![]() ��pH=5���ʴ�Ϊ��5��
��pH=5���ʴ�Ϊ��5��
��������pH������ʱ���轫pH����5��ȥFe3+��Al3+����ע�ⲻ���������ʣ�����ѡ�õ��Լ���MgO��MgCO3 ��Mg(OH)2 �ȣ��ʴ�Ϊ��AC��
��4������þ�������У�������֪�ں�Mg2+����Һ�м���HCO3-Ҫ����MgCO3nH2O������ͬʱ��CO2����ų������ӷ���ʽΪ��Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2��������þ��ʱ���¶ȳ���60���������¶ȴٽ�M g2+ˮ������Mg(OH)2��Mg(OH)2��CO2��Ӧ���ɵļ�ʽ̼��þ[Mg2(OH)2CO3]���ʣ��ʴ�Ϊ��Mg2+��2HCO3-��(n-1)H2O=MgCO3nH2O����CO2�������´ٽ�Mg2+ˮ�⣨�����´ٽ�MgCO3��������ȫˮ�⣩��
��5��ijС��ͬѧ��ȡ15.6gMgCO3��nH2O�������ط�����������ʣ������������¶ȱ仯��������ͼ��ʾ��MgCO3��nH2O���ȷֽ�����MgO��CO2��H2O������ʣ�������MgO��n(MgO)=![]() =0.1mol������þԭ���غ㣬n(MgO)= n(MgCO3)= n(MgCO3��nH2O) =0.1mol��m(MgCO3)=0.1��84g��mol
=0.1mol������þԭ���غ㣬n(MgO)= n(MgCO3)= n(MgCO3��nH2O) =0.1mol��m(MgCO3)=0.1��84g��mol![]() =8.4g��n(H2O)=
=8.4g��n(H2O)=![]() =0.4mol����n=4���ʴ�Ϊ��4��
=0.4mol����n=4���ʴ�Ϊ��4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�

��1���������ǿ����˳��Ϊ___(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02mol��L-1��CH3COOH��Һ�ĵ����ԼΪ___�����Ϊ10 mL pH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��___����(��������������������=��)��
��3����������CH3COO-��CO32-��HSO3-��SO32-����Һ�н��H+�������ɴ�С��˳��Ϊ_____��
��4��NaHSO3��Һ�����Ե�ԭ��_____(���ӷ���ʽ���ʵ���������)������Һ������Ũ���ɴ�С�Ĺ�ϵ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ��ʾ��ͼ��ͼ��ʾ������˵������ȷ���ǣ� ��
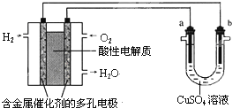
A.ȼ�ϵ�ع���ʱ��������ӦΪO2+4H++4e����2H2O
B.a����ͭ��b������ʱ����ʵ�����϶�ͭ
C.a���Ǻ�п�����Ĵ�ͭ��b���Ǵ�ͭ��a���ܽ�ͭ��������b��������ͭ�������
D.��a��b������Ϊʯīʱ������ͬ�����£�a���������������������ĵ�H2�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫���200mLH2SO4��CuSO4�Ļ����Һ��ͨ��һ��ʱ����������ռ���2.24L���壨��״������ԭ�����Һ��Cu2+�����ʵ���Ũ��Ϊ�� ��
A.0.2mol��L��1B.0.3mol��L��1C.0.4mol��L��1D.0.5mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ü��Ա�Ҫ�ĵ������Ӻ�ﵽ��ͭ������Ŀ�ġ�

��A�ձ���________________(����ب���ԭ��ب�),
B�ձ���________________(����ب���ԭ��ب�)��
������Zn��B�ձ��е�___________����������ͭ��������ͭ������B�ձ���Ӧ��ʢ____________��Һ��
���ֱ�д��ʯī���ʹ�ͭ���ĵ缫��Ӧʽ
ʯī����____________________________________��
��ͭ����____________________________________��
���������0.65 g����Cu������������________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ���ֶ�����Ԫ�أ����ǵ�ԭ��������������A����������Ԫ�ؾ�����ͬһ���ڣ�BԪ������������Ӧ��ˮ��������������⻯�ﷴӦ����һ����X��C���γ����ֳ�����ΪҺ̬���⻯�D��Cͬ���塣������˵���в���ȷ���ǣ� ��
A.ԭ�Ӱ뾶��С��ϵ��A<C<B
B.��0.1molL-1��X��Һ�У���Һ�������ӵ���ĿС��0.1NA
C.C��D����Ԫ�طֱ���A�γɵ��������ķе�C��D��Ҫ��
D.������X�����ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ���������������õ����ʣ�Ϊ�ⶨ���ȣ��������µζ�������
A.�� 250 mL ������ƿ�ж������ 250 mL �ռ���Һ
B.����Һ����ȡ 25 mL �ռ���Һ����ƿ�в��μ���ָʾ������
C.����ƽ��ȷ��ȡ�ռ���Ʒ Wg�����ձ���������ˮ�ܽ�
D.�����ʵ���Ũ��Ϊ c �ı�������Һװ����ʽ�ζ��ܣ�����Һ�棬�ǿ�ʼ����Ϊ V1 E������ƿ�µ�һ�Ű�ֽ���ζ����յ㣬�Ƕ��� V2
�ش����и����⣺
(1)��ȷ���������˳���ǣ�����ĸ��д�� _______�� ________�� ________��D�� ______��
(2)D ������Һ��Ӧ���ڵ� ______�����첿��Ӧ ______��
(3)�ζ��յ�ʱ��ƿ����ɫ�仯�� ______��
(4)����ʽ�ζ��ܲ��ñ�������ϴ����������������ȷ��ǰ���£���Բⶨ�����ָ�ռ�Ĵ��ȣ��к�Ӱ�죿______������ƫ������������������������
(5)���ռ���Ʒ���ȵļ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������̼���ɼ���Ĺ�����ͼ��ʾ������˵����ȷ���ǣ�NAΪ�����ӵ�������ֵ��
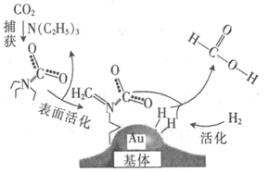
A.��״���£�22.4 L CO2�������ĵ�����ĿΪ16NA
B.10.1 g N��C2H5��3�������ļ��Թ��ۼ���ĿΪ2.1NA
C.2 mol Au��2 mol H2�������ķ�����Ŀ��Ϊ2NA
D.100 g 46%�ļ���ˮ��Һ����������ԭ����ĿΪ5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����˽̰�̲�ʵ�顰��200mL�ձ��з���20g���ǣ�C12H22O11������������ˮ��������ȣ�Ȼ���ټ���15mL��������Ϊ98%Ũ���ᣬѸ�ٽ��衱��������̽����
��1���۲����������ȱ�ƣ�����ڣ�������ͣ��γ����ɶ�ĺ���״��ɫ���ʣ�ͬʱ�ŵ��̼�����ζ����ѹ�˺�ɫ����ʱ���о���Ӳ������ˮ�г�Ư��״̬��ͬѧ�������������Ʋ�����н��ۣ�
��Ũ�������ǿ������ ��Ũ���������ˮ�� ��Ũ���������ˮ�Ԣ�Ũ����������� �ݺ�ɫ���ʾ���ǿ������
�������ݲ���ֵ���_________������ţ���
��2��Ϊ����֤������Ũ���ᷴӦ���ɵ���̬���ͬѧ�����������װ�ã�

�Իش��������⣺
��ͼ1��A�����ѡ������װ��_________�����ţ���
��ͼ1�� Bװ����װ�Լ���_________��Dװ�����Լ���������_________��Eװ���з�����������_________��
��ͼ1��Aװ����ʹ�����ȱ�ڵĻ�ѧ��Ӧ����ʽΪ_________����������͵Ļ�ѧ����ʽΪ��_________��
��ijѧ����ͼ2����ʵ��ʱ������DƿƷ�첻��ɫ��Eװ�����������ݳ���Fװ�������Ը��������Һ��ɫ��dz���Ʋ�Fװ�������Ը��������Һ��ɫ��dz��ԭ��_________���䷴Ӧ�����ӷ���ʽ��_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com