

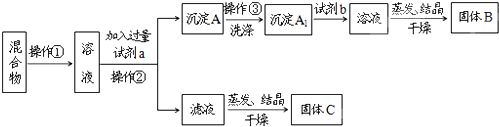
分析 本题探究的是利用高岭土[其主要成分是Al2O3•2SiO2•2H2O]和纯碱为原料制新型净水剂的流程,根据流程可知混合物在加热熔融的过程中生成了硅酸钠和偏铝酸钠,加水溶解后过滤除去不溶物,滤液中加足量盐酸得到沉淀硅酸,过滤后的溶液中含AlCl3,
①由分析可知,A是纯碱与Al2O3和SiO2在熔融状态生成的产物,A加水溶解过滤除去不溶物后得到A中可溶性盐溶液的混合物,滴加过量盐酸后会生成硅酸沉淀和氯化铝溶液;
②根据题目所提示的信息及结合硅酸盐工业理论,书写化学方程式;
③所选择的仪器不能和熔融高岭土及纯碱试样发生反应.
解答 解:①氧化铝和二氧化硅在高温熔融状态下与纯碱反应生成硅酸钠和偏铝酸钠,A中加水溶解并过滤后得到的主要是硅酸钠与偏铝酸钠的混合液,滴加过量盐酸会生成硅酸沉淀和氯化铝溶液,过滤后的不溶物为硅酸,故答案为:NaAlO2和Na2SiO3;AlCl3和H2SiO3;AlCl3;D:H2SiO3;
②氧化铝以及二氧化硅与碳酸钠的反应为:Na2CO3+Al2O3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,故答案为:Na2CO3+Al2O3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑、Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
③瓷坩埚、玻璃坩埚的成分中含有二氧化硅,能和纯碱发生反应,氧化铝坩埚也能和纯碱发生反应,在加热时反应易使坩埚炸裂,则应选择铁坩埚,故答案为:D.
点评 本题考查含硅元素的化合物的性质,可以根据所学知识进行回答,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2CO(g)+2NO(g)═N2(g)+2CO2(g)在298℃时能自发进行,则它的△H>0 | |
| B. | 电解含Mg(NO3)2和Cu(NO3)2的水溶液,阴极上阳离子得电子顺序是Cu2+、H+、Mg2+ | |
| C. | 电解精炼铜的整个过程中,阳极质量的减少量与阴极质量的增加量相等 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程中不考虑温度变化),从针筒顶端观察,气体颜色逐渐变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | AgNO3 | C. | NaHCO3 | D. | 酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
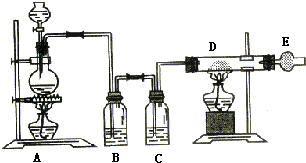 如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:
如图是制取无水氯化铜的实验装置图,将分液漏斗中的浓硫酸滴加到盛有固体食盐和二氧化锰混合物的烧瓶中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种物质所含分子数目从大到小的顺序是:②>③>④>① | |
| B. | 四种物质质量从大到小的顺序是:③>②>④>① | |
| C. | 四种气体在标准状况下的体积从大到小的顺序是:②>③>④>① | |
| D. | 四种物质所含原子数目从大到小的顺序是:②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中CO2过量,溶液的pH<7 | B. | 水的离子积常数Kw<10-14 | ||
| C. | 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com