
分析 (1)抗酸药除了含有抑酸剂外,还含有一些调味剂、黏合剂等辅料;
(2)抗酸药能和胃酸中的盐酸发生复分解反应,以此写出化学方程式.
解答 解:(1)抗酸药片中除了能与盐酸作用的有效成分外,还可能含有调味剂如糖、黏合剂如淀粉等,故答案为:淀粉;糖;
(2)碳酸钙和盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O,氢氧化镁和盐酸反应的化学方程式:Mg(OH)2+2HCl═MgCl2+2H2O,
故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;Mg(OH)2+2HCl═MgCl2+2H2O.
点评 本题考查本题考查药物的成分和疗效,题目难度不大,注意理解反应的原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
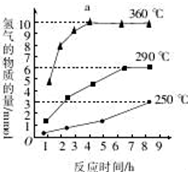 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式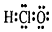 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com