
分析 (1)Pb3O4与浓盐酸反应生成氯化铅和水、氯气,依据氧化还原反应规律配平方程式;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,硅酸钠与盐酸反应生成氯化钠和硅酸沉淀;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(4)碘与亚硫酸发生氧化还原反应生成碘化氢和硫酸;
(5)高铁酸根离子酸性环境下反应生成三价铁离子、氧气和水;
(6)过氧化氢酸性环境下氧化二价铁离子生成三价铁离子;
解答 解:(1)Pb3O4与浓盐酸反应生成氯化铅和水、氯气,化学方程式:Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O;
故答案为:Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,方程式:SiO2+2NaOH=Na2SiO3+H2O,硅酸钠与盐酸反应生成氯化钠和硅酸沉淀,方程式:Na2SiO3+2HCl=2NaCl+H2SiO3↓;
故答案为:SiO2+2NaOH=Na2SiO3+H2O Na2SiO3+2HCl=2NaCl+H2SiO3↓;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式:2Na2O2+2CO2=2Na2CO3+O2
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)碘与亚硫酸发生氧化还原反应生成碘化氢和硫酸,方程式:I2+H2SO3+H2O═4H++2I-+SO42-;
故答案为:I2+H2SO3+H2O═4H++2I-+SO42-;
(5)高铁酸根离子酸性环境下反应生成三价铁离子、氧气和水,离子方程式:4FeO42-+20H+═4Fe3++3O2↑+10H2O;
故答案为:4FeO42-+20H+═4Fe3++3O2↑+10H2O;
(6)过氧化氢酸性环境下氧化二价铁离子生成三价铁离子,化学方程式:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
故答案为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
点评 本题考查了化学方程式的书写,为高考频考题型,明确物质的性质、发生反应的实质是解题关键,注意氧化还原反应方程式应遵循原子个数、得失电子数守恒规律,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的KNO3 溶液500 ml | B. | 0.05mol/L的K2SO4 溶液300ml | ||
| C. | 0.04mol/L的K3PO4 溶液100 ml | D. | 0.06mol/L的KHCO3 溶液120 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
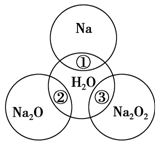 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 用10 mL量筒量取9.2 mL NaCl溶液 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.16mol | B. | 0.21mol | C. | 0.30mol | D. | 0.48mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | B. | 2SO2(g)+O2(g)?2SO3(g)△H<0 | ||
| C. | H2(g)+I2(g)?2HI(g)△H>0 | D. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com