
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
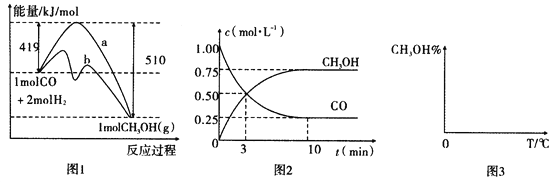
请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线__________(在曲线上标出p1、p2,且p1>p2)。
(5)科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2
(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式_______。
【答案】 b 放热 AB 0.15mol/(L·min) 12 正反应方向  CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H=-280.9KJ/mol
CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H=-280.9KJ/mol
【解析】试题分析:(1)由图可知,曲线b降低了反应所需的活化能,则b使用了催化剂,又该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应; (2)a、起始充入的CO为1mol,则起始时CO的浓度是0.5mol/L,故A错误;增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B错误;该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故c正确;再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时n(CH3OH)/n(CO)会增大,故D增强;(3)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为![]() =0.075molL-1min-1,
=0.075molL-1min-1,
因反应速率之比等于化学计量数之比,则v(H2)=0.075molL-1min-1×2=0.15molL-1min-1,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始1mol/L 2mol/L 0
转化0.75mol/L 1.5mol/L 0.75mol/L
平衡0.25mol/L 0.5mol/L 0.75mol/L
则化学平衡常数K=![]() 12 L2mol-2,
12 L2mol-2,![]()
![]() <K,反应进行的方向为正反应方向;
<K,反应进行的方向为正反应方向;
(4)CO(g)+2H2(g)![]() CH3OH(g)△H<0,
CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
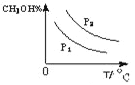 ,
,
(5)根据盖斯定律甲醇完全燃烧生成液态水的热化学方程式CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H=-280.9KJ/mol。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列有关说法正确的是( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为2NA
C.71gCl2所含原子数为2NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求完成填空:
(1)下列物质中,电解质;非电解质A.氢氧化钠溶液 B.液氨 C.氯化钠晶体 D.二氧化碳 E.硫酸钡
(2)100mLFe2(SO4)3溶液中含有Fe3+11.2g,其中铁离子的物质的量n(Fe3+)= , 硫酸根离子的物质的量浓度c(SO ![]() )= , 取25mL溶液稀释到100mL,则稀释后溶液中Fe3+的物质的量浓度是c(Fe3+)= , 稀释后溶液中Fe2(SO4)3的质量m= .
)= , 取25mL溶液稀释到100mL,则稀释后溶液中Fe3+的物质的量浓度是c(Fe3+)= , 稀释后溶液中Fe2(SO4)3的质量m= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是:
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C8H10的芳香烃,苯环上的一硝基(﹣NO2是一种官能团)取代物只有一种,该芳香烃的名称是( )
A.乙苯
B.邻二甲苯
C.间二甲苯
D.对二甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法错误的是
A.SO2可用作食品添加剂B.CCl4 可用于鉴别溴水和碘水
C.浓氨水可用来清洗试管壁的银镜D.Na2S 可除去污水中的 Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.研究过程如图:![]()
根据要求回答问题:
(1)用浓盐酸配制100ml 1mol.L﹣1稀盐酸,需要的玻璃仪器:烧杯、胶头滴管、量筒、玻璃棒、还有 , 用量筒量取一定体积的浓盐酸时,仰视会造成稀盐酸的浓度(填偏大、偏小、不变).
(2)用KSCN溶液检验溶液中Fe3+存在的离子方程式:;证明Fe3+存在的实验现象是:;
(3)甲同学认为:废铁屑加入适量的盐酸后,除了铁锈和铁都能与稀盐酸反应以外,同时还发生另一个反应,则这个反应的离子方程式为:;
(4)写出A→B反应的离子方程式:B→C变化中,写出FeCl3溶液与金属铜发生反应的化学方程式: .
(5)为了对C溶液回收利用,向C溶液中加入一定量的铁粉,充分反应后,如果溶液内有较多Cu2+和相当量的Cu,则容器内不可能有的金属或金属离子 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com