
分析 (1)硅酸盐改写为氧化物的一般方法为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO•nSiO2•mH2O);某短周期元素与硼同族,则铝的最外层电子排布式为3S23P1;
(2)A与水反应生成两种碱,说明一种是氢氧化镁另一种是一水合氨,所以是镁条与氮气反应生成氮化镁,则氮在元素表中的位置为二周期第ⅤA族,氮化镁与水反应的方程式为:Mg3N2+6H2O═3Mg(OH)2+2NH3;
(3)硫元素的非金属强于硼元素,硼元素核外有电子排布为1s22s22p1,所以硼元素原子中有 三种能量不同的电子;
(4)硼的某单质的熔点高,说明其是原子晶体,根据元素周期律,相邻元素性质具有相似性,原子晶体是空间网状态结构,分析解答.
解答 解:(1)硅酸盐改写为氧化物的一般方法为:碱性氧化物、两性氧化物、酸性氧化物、水(xMO•nSiO2•mH2O),所以Mg3(BO3)2•2MgSO4•6H2O氧化物形式为5MgO•2SO3•B2O3•6H2O;某短周期元素与硼同族,则铝的最外层电子排布式为3S23P1,故答案为:5MgO•2SO3•B2O3•6H2O; 3S23P1;
(2)A与水反应生成两种碱,说明一种是氢氧化镁另一种是一水合氨,所以是镁条与氮气反应生成氮化镁,则氮在元素表中的位置为二周期第ⅤA族,氮化镁与水反应的方程式为:Mg3N2+6H2O═3Mg(OH)2+2NH3,故答案为:二;ⅤA; Mg3N2+6H2O=3Mg(OH)2+2NH3;
(3)硫元素的非金属强于硼元素,硼元素核外有电子排布为1s22s22p1,所以硼元素原子中有 三种能量不同的电子,故答案为:小于;三;
(4)硼的某单质的熔点高,说明其是原子晶体,根据元素周期律,相邻元素性质具有相似性,原子晶体是空间网状态结构,故选:B C.
点评 本本题考查硅酸盐改写成氧化物的形式方法、知识运用能力,涉及原子核外电子排布、化学方程式的书写等知识点,综合性较强,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na2O2中的化学键类型有离子键和非极性共价键;
,Na2O2中的化学键类型有离子键和非极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当n=1时,X可能是C | B. | 当n=1时,X可能是Al | ||
| C. | 当n=2时,X可能是S | D. | 当n=2时,X可能是Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使溴水褪色 | |
| B. | 用新制的氢氧化铜浊液不能检验淀粉和纤维素是否发生了水解 | |
| C. | 油脂的水解反应,都是皂化反应 | |
| D. | 橄榄油、茶籽油和花生油等都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO32-)=0.5 mol•L-1的溶液中:ClO-、Na+、Cl-、CO32- | |
| B. | pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ | |
| C. | 强碱性溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 水电离产生的c(H+)=1×10-14mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
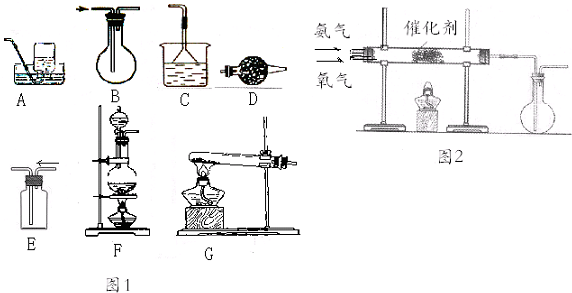
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | 向0.1mol/LpH=1的KHA溶液中加入KOH溶液:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
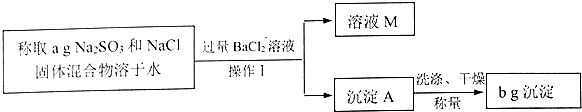
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com