
����Ŀ�������������ӵ�������Ŀ��
(1) 0.3 mol H2O������������ԭ������________��NH3������������ԭ������ȡ�
(2) 12 g �������������ۼ������ʵ�����________��
(3)������Ϊ0.5NA��CO2���ӣ�������________��
(4) 9.5 g A���ӵ����ʵ�����0.25 mol ��A��Ħ��������________��N��B���ӵ�������m g����B��Ħ��������________��24 g O3�еķ�������________g 18O2�еķ�������ȡ�
���𰸡�0.2NA2.8 mol22 g38 g��mol��1��![]() g��mol��118
g��mol��118
��������
(1)��0.3mol H2O����������ԭ������ȵ�NH3�������ʵ���Ϊ��![]() =0.2mol���ʰ���������ĿΪ0.2NA=0.2mol��6.02��1023mol-1=1.204��1023���ʴ�Ϊ��1.204��1023(��0.2NA)��
=0.2mol���ʰ���������ĿΪ0.2NA=0.2mol��6.02��1023mol-1=1.204��1023���ʴ�Ϊ��1.204��1023(��0.2NA)��
(2)12g��������ʵ���Ϊ��![]() =0.4mol����������к�7�����ۼ�����0.4mol�����к��й��ۼ������ʵ���Ϊ��0.4mol��7=2.8mol���ʴ�Ϊ��2.8mol��
=0.4mol����������к�7�����ۼ�����0.4mol�����к��й��ۼ������ʵ���Ϊ��0.4mol��7=2.8mol���ʴ�Ϊ��2.8mol��
(3)������Ϊ0.5NA��CO2���ӵ�������![]() =0.5mol��������Ϊ��44g/mol��0.5mol=22g���ʴ�Ϊ��22g��
=0.5mol��������Ϊ��44g/mol��0.5mol=22g���ʴ�Ϊ��22g��
(4)9.5gA���ӵ����ʵ�����0.25mol��A��Ħ�������ǣ�![]() =38g/mol��
=38g/mol��
N��B���ӵ�������mg��B�����ʵ���Ϊ![]() mol����B��Ħ�������ǣ�
mol����B��Ħ�������ǣ�![]() =
=![]() g/mol��24gO3���ӵ����ʵ���Ϊ��
g/mol��24gO3���ӵ����ʵ���Ϊ��![]() =0.5mol�����ʵ������ʱ���з�������ͬ����18O2�����ʵ���Ϊ0.5mol��0.5mol18O2������Ϊ��36g/mol��0.5mol=18g���ʴ�Ϊ��38 g��mol��1��
=0.5mol�����ʵ������ʱ���з�������ͬ����18O2�����ʵ���Ϊ0.5mol��0.5mol18O2������Ϊ��36g/mol��0.5mol=18g���ʴ�Ϊ��38 g��mol��1�� ![]() g��mol��1��18��
g��mol��1��18��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ��ǿ������������Ϊˮ��������������ز��ϡ�������Ԫ�صĻ��ϼ�Ϊ
A. +2B. +5C. +6D. +8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
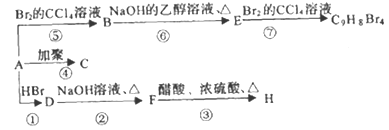
����Ŀ��������M��һ�ֺϳ�ҩƷ���м��壬��ϳ�·����ͼ��ʾ��
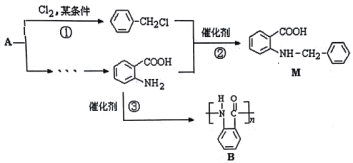
��֪��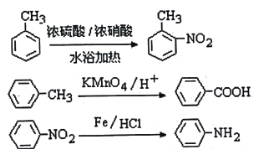
�������ԣ��ױ�������
(1)д����Ӧ���Ļ�ѧ����ʽ_____________��
(2)��Ӧ������____��Ӧ�����л���Ӧ���ͣ���
(3)д��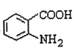 �й����ŵ�����__________��
�й����ŵ�����__________��
(4)HΪ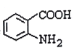 ��ͬ���칹�壬����������������H��ͬ���칹�干��______�֣������������������Һ�4�ֲ�ͬ��ԭ�ӵ�ͬ���칹��Ľṹ��ʽ��___________��
��ͬ���칹�壬����������������H��ͬ���칹�干��______�֣������������������Һ�4�ֲ�ͬ��ԭ�ӵ�ͬ���칹��Ľṹ��ʽ��___________��
���������ԣ��ױ����� �������ں��б��� ���ܷ���ˮ�ⷴӦ
(5)���������A�ϳ�B�ĺϳ�·��_________________________________________________________��
��ʾ�����ϳɹ��������Լ���ѡ�� ���ϳ�·�߱�ʾ����ʾ����ͼ��ʾ��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��![]() (��Ҫ����)��1molij��A���ȼ�պ���Եõ�9molCO2��5molH2O����A�к��б������ұ����������������⡣����A�ڲ�ͬ�������ܷ���������ʾ��һϵ�б仯�������
(��Ҫ����)��1molij��A���ȼ�պ���Եõ�9molCO2��5molH2O����A�к��б������ұ����������������⡣����A�ڲ�ͬ�������ܷ���������ʾ��һϵ�б仯�������
��1��A�ķ���ʽΪ___________________��
��2��������Ӧ�У�����________________��Ӧ������_________________��Ӧ��(�Ӧ����)
��3��д���������ʵĽṹ��ʽ��C________________��E_______________��H_______________��
��4��д��D��F��Ӧ�Ļ�ѧ����ʽ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�

�ش��������⣺
��1��NaClO2��Cl�Ļ��ϼ�Ϊ_______��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ__________________________________��
��3������⡱����ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�Ϊ________��________������⡱��������Ӧ����Ҫ������______��
��4����β�����ա������ա���⡱�����ų�������ClO2�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________���÷�Ӧ������������_________��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ____����������������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������β����Ǵ�ͳ�����ǽ������ϡ������йع����β��ϵ�˵����ȷ����(����)
A.��ͨ��������Ҫ�ɷ��Ǵ��ʯ��ʯ��ʯӢ
B.����ˮ�����Ҫԭ����ʯ��ʯ�����
C.ˮ�����ijɷ��ǹ����ơ�����ƺͶ�������
D.�����ȴ����Ľṹ���ܣ���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ������ģ��ں��¡����������£���˵�����淴Ӧ��H2(g)+I2(g) 2HI(g)�ﵽƽ��״̬����
A. �����ѹǿ���ֲ��� B. v(H2)��=2v(HI)��
C. ������ܶȱ��ֲ��� D. �������ɫ���ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��EΪԭ���������������5�ֶ�����Ԫ�أ�A����������������Ӳ�����������B���γ�˫ԭ�������ӣ�C��B���γ����ֳ��������ӻ����B��Eͬ���壬C��D��E������������Ӧ��ˮ����֮���������ܷ�Ӧ�����κ�ˮ����ش��������⣺
��1��B��˫ԭ�������ӵ���ʽΪ_______���û�ѧʽ��ʾһ����B��C��E��ɵ�����_____��
��2��B���⻯���E���⻯��ķе�____ (����������������)��������__________��
��3��B��C��D��ɻ������ˮ��Һ�����AB2��Ӧ�����ӷ���ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����m1gͭ���Ͻ�Ͷ�뵽1 L��H2SO4��HNO3�Ļ����Һ�����Ͻ���ȫ�ܽ��ֻ����VL ����������������״��������Ӧ�����Һ����μ���1mol/L NaOH��Һ�����ɳ���������������NaOH��Һ������Ĺ�ϵ����ͼ��ʾ������˵���в���ȷ������

A. 2c(H2SO4) + c(HNO3) = 0.8 mol��L-1
B. m2��m1=5.1
C. ԭ�Ͻ���������������Ϊ34.7%
D. V = 2.24
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com