
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
分析 (1)利用盖斯定律写出甲醇不完全燃烧生成液态水的热化学方程式;
20g甲醇的物质的量=$\frac{20g}{32g/mol}$=$\frac{5}{8}$mol,根据甲醇和热量之间的关系式计算放出的热量;
(2)该反应的焓变=反应物总键能-生成物总键能;化学平衡常数只与温度有关,温度不变,平衡常数不变;
(3)将乙中甲醇完全转化为CO和H2,CO和H2的物质的量分别是1mol、2mol,所以甲、乙是等效平衡,平衡时甲、乙容器中各物质浓度分别相等;
丙中CO和氢气的物质的量是甲的2倍,可以将丙的容器增大为甲的2倍,此时二者是一样状态,然后将丙容器体积缩小至原来体积,相当于增大压强,平衡正向移动;
(4)该体系体积可变,反应前后气体密度增大,质量不变,则体积减小,平衡向正反应方向移动;
(5)①燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
②电解池中,阳极上铜离子得电子生成Cu,根据转移电子相等计算消耗空气体积.
解答 解:(1)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol①
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol②
H2O(g)=H2O(1)△H=-44.0kJ/mol③
根据盖斯定律,将已知反应①-②-③×4得到2CH3OH(l)+O2(g)=2CO(g)+4H2O(l),所以该反应的△H=(-1275.6kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4=-533.6kJ•mol-1,即2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1;
20g甲醇的物质的量=$\frac{20g}{32g/mol}$=$\frac{5}{8}$mol,1mol甲醇不完全燃烧放出533.6kJ热量,则$\frac{5}{8}$mol甲醇不完全燃烧放出的热量=$\frac{5}{8}$mol×533.6kJ=333.5kJ;
故答案为:2CH3OH(l)+O2(g)=2CO(g)+4H2O(l)△H=-533.6kJ•mol-1;333.5kJ;
(2)该反应的焓变=反应物总键能-生成物总键能=(2d+3×2×b-3a-c-e-2e)kJ/mol=(2d+6b-3a-c-3e)kJ/mol;
化学平衡常数只与温度有关,温度不变,平衡常数不变,所以改变压强时平衡常数不变,
故答案为:(2d+6b-3a-c-3e)kJ/mol;不变;
(3)将乙中甲醇完全转化为CO和H2,CO和H2的物质的量分别是1mol、2mol,所以甲、乙是等效平衡,平衡时甲、乙容器中各物质浓度分别相等;
丙中CO和氢气的物质的量是甲的2倍,可以将丙的容器增大为甲的2倍,此时二者是一样状态,然后将丙容器体积缩小至原来体积,相当于增大压强,平衡正向移动;
A.甲、乙是等效平衡,则平衡时甲醇浓度相等,所以c1=c2,故正确;
B.根据以上分析知,丙中CO的转化率大于甲,所以放出的热量大于甲的2倍,所以2Q1<Q3,故错误;
C.根据B知,丙中的转化率大于甲,但小于甲的2倍,即2a1>a3,故错误;
D.甲乙是等效平衡,则a1+a2=1,故正确;
E.甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量,故错误;
故选AD;
(4)该体系体积可变,反应前后气体密度增大,质量不变,则体积减小,平衡向正反应方向移动,则正反应速率大于逆反应速率,故答案为:>;
(5)①燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②电解池中,阳极上铜离子得电子生成Cu,原电池中正极上氧气得电子发生还原反应,阳极反应式为Cu2++2e-=Cu、正极反应式为 O2+4e-+2H2O=4OH-,生成Cu转移电子的物质的量=$\frac{3.2g}{64g/mol}×2$=0.1mol,根据转移电子相等得消耗氧气体积=$\frac{\frac{0.1mol}{4}×22.4L/mol}{20%}$=2.8L,
故答案为:2.8L.
点评 本题考查较综合,涉及原电池和电解池原理、化学平衡计算、盖斯定律等知识点,这些都是高频考点,难点是电极反应式的书写、等效平衡等知识点,注意(3)题甲、丙计算技巧,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+ | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O $\frac{\underline{\;电解\;}}{\;}$ Fe(OH)2+H2↑ | |
| D. | 表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
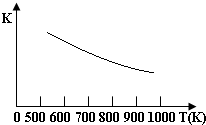 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | CH2=CH2通入溴的四氯化碳溶液中 | 溶液褪色 | CH2=CH2发生取代反应 |
| B | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| C | 将盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| D | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生取代反应生成溴苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
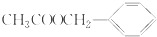 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: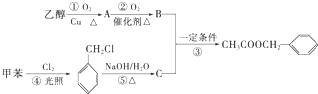
 .
.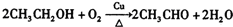 ;
;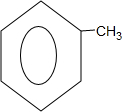 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$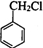 +HCl.
+HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com