

分析 I.工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;
向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)分离难溶性固体和溶液采用过滤方法;进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒;
(2)滤渣I的主要成分为Cu(OH)2、Fe(OH)3,试剂乙的名称氨水;
(3)加入试剂甲的目的是将亚铁离子氧化为铁离子;
(4)废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
II.(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-.
解答 解:I.工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;
向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)分离难溶性固体和溶液采用过滤方法,所以操作I名称是过滤;进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒,故答案为:过滤;玻璃棒;
(2)通过以上分析知,滤渣I的主要成分为Cu(OH)2、Fe(OH)3,试剂乙的名称氨水,
故答案为:Cu(OH)2、Fe(OH)3;氨水;
(3)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,
故答案为:将Fe2+氧化成Fe3+;
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,所以废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-,故答案为:2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
II.(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-,故不用Cu电极来代替Fe电极,故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
点评 本题考查物质的分离和提纯,为高频考点,涉及实验基本操作、氧化还原反应、电解原理等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难点是(5)题电解原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用Fe2+将饮用水中少量ClO2-氧化成为Cl-:4Fe2++ClO2-+4H+═4Fe3++Cl-+2H2O | |
| B. | 向烧碱溶液中加入铝:Al+2OH-═AlO2-+H2↑ | |
| C. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O═SO32-+2NH4++H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
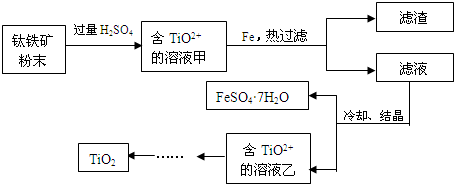
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:
BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等.工业上可用H2与重晶石(BaS04)在高温下反应制备BaS,热化学方程式为BaS04(s)+4H2(g)?BaS(s)+4H20(g)△H=+xkJ•mol-1(x>0).回答下列问题:| 时间/min | 0 | t | 2t | 3t | 4t |
| n(H2)/mol | 2.00 | 1.50 | n | 0.90 | 0.80 |
| 试验编号 | T/℃ | c起始(H2)/mol•L-1 | 重晶石的比表面积/m2•g-1 |
| Ⅰ | 850 | c1 | 3.4 |
| Ⅱ | T1 | 0.80 | 7.6 |
| Ⅲ | 900 | 0.80 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.
,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比水的密度小 | |
| B. | 氨气极易溶于水 | |
| C. | SbH3的沸点比PH3高 | |
| D. | 溶解度:邻羟基苯甲醛<对羟基苯甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点-218℃,难溶于水 | |
| B. | 熔点3 900℃,硬度很大,不导电 | |
| C. | 难溶于水,固体时导电,升温时导电能力减弱 | |
| D. | 难溶于水,熔点高,固体不导电,熔化时导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com