
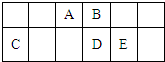
| A. | 原子半径的大小顺序为:rA>rB>rC>rD>rE | |
| B. | 元素D的最高价氧化物对应的水化物的酸性比E的强 | |
| C. | A、D两种元素在自然界中都存在相应的单质 | |
| D. | C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应 |
分析 短周期元素A、B、C、D、E在元素周期表中的相对位置可知,AB在第二周期,CDE在第三周期,根据元素在周期表中位置可知,A为N元素,B为O元素,C为Al元素,D为S元素,E为Cl元素;
A.电子层数越多,半径越大,电子层数相同时,原子序数越大,半径越小;
B.同周期从左到右非金属性逐渐增强,其最高价氧化物对应的水化物的酸性增强;
C.N、S在自然界中存在单质;
D.C为Al元素,其最高价氧化物的水化物为两性氢氧化物,E为Cl元素,其最高价氧化物的水化物为强酸.
解答 解;短周期元素A、B、C、D、E在元素周期表中的相对位置可知,AB在第二周期,CDE在第三周期,根据元素在周期表中位置可知,A为N元素,B为O元素,C为Al元素,D为S元素,E为Cl元素;
A.电子层数越多,半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径的大小顺序为:rC>rD>rE>rA>rB;故A错误;
B.同周期从左到右非金属性逐渐增强,其最高价氧化物对应的水化物的酸性增强,则元素D的最高价氧化物对应的水化物的酸性比E的弱,故B错误;
C.N、S在自然界中存在单质,分别为氮气和硫磺,故C正确;
D.C为Al元素,其最高价氧化物的水化物为两性氢氧化物,E为Cl元素,其最高价氧化物的水化物为强酸,二者能发生反应,故D错误.
故C.
点评 本题考查了元素周期表的结构和元素性质的应用,题目难度不大,注意根据元素在周期表中的位置判断出具体的元素,再结合元素周期律解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I A族元素又称为碱金属元素 | |
| B. | 副族和Ⅷ族中的元素均为过渡元素 | |
| C. | 族的序数都等于该族元素原子的最外层电子数 | |
| D. | 元素周期表中每个纵列为一族,共有18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

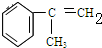 C的结构简式:
C的结构简式: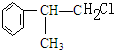 .
.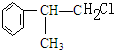 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
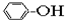 ⑥
⑥ ⑦
⑦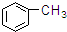 ⑧
⑧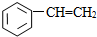
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
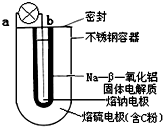 钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )
钠-硫($\frac{Na}{{S}_{8}}$)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法错误的是( )| A. | 放电时b为电池的负极 | |
| B. | 充电时阴极反应式为:Na++e-=Na | |
| C. | 充电时,阳极处发生还原反应 | |
| D. | 放电时Na+可以穿过固体电解质流向a电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com