
| A. | KClO3在反应中被还原 | |
| B. | 被还原与被氧化的氧元素的质量比为1:5 | |
| C. | H204在反应中既没被氧化也没被还原 | |
| D. | 生成1mol Cl2时有2mol电子转移 |
分析 在反应5KC1+KC103+3H2S04=3K3SO4+3Cl2+3H20中,氯化钾中的氯由-1价变成0价,失电子发生氧化反应,而KC103中的氯由+5价变成0价,得电子发生还原反应,由此分析解答.
解答 解:A、KC103中的氯由+5价变成0价,得电子是氧化剂,发生还原反应,KClO3在反应中被还原,故A正确;
B、氯化钾中的氯由-1价变成0价,失电子发生氧化反应被氧化,而KC103中的氯由+5价变成0价,得电子发生还原反应,被还原,所以被还原与被氧化的氧元素的质量比为1:5,故B正确;
C、硫酸分子中各元素化合价未变,所以反应中既没被氧化也没被还原,故C正确;
D、生成3mol Cl2时有5mol电子转移,所以生成1mol Cl2时有$\frac{5}{3}$mol电子转移,故D错误;
故选D.
点评 本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识相关概念及相关物质的性质的判断,难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁杵成针 | B. | 抱薪救火 | C. | 闭门造车 | D. | 刻舟求剑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项化合物 | A | B | C | D |
| Y | NH3 | Kl | MgO | H20 |
| W | HCl | KCl | C02 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
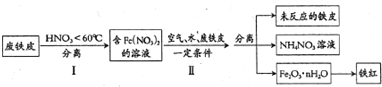
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
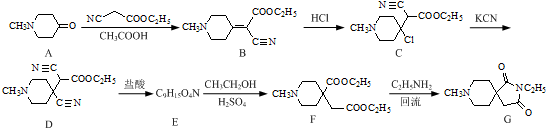
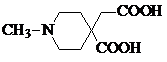 .
.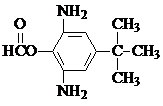 或
或 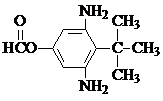 .
.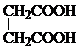 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备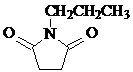 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com