
| A. | 半导体材料砷化镓 | B. | 透明陶瓷材料硒化锌 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
科目:高中化学 来源: 题型:解答题
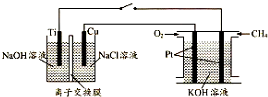
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者不可能是同系物 | |
| B. | 二者一定是同分异构体 | |
| C. | 各1mol的A和B分别燃烧生成CO2的质量一定相等 | |
| D. | 二者最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
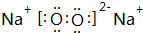 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
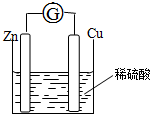 将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com