
| A. | 浓盐酸在此反应中只体现还原性 | |
| B. | 产生0.1mol Cl2时转移电子数目为NA | |
| C. | 还原剂和还原产物的物质的量之比为2:1 | |
| D. | 当有0.2mol氧化剂参与反应时,标准状况下该反应产生气体的体积为6.72L |
分析 A.该反应中氯酸钾中Cl元素化合价由+5价变为+4价、浓盐酸中部分Cl元素化合价由-1价变为0价,转移电子数为2,浓盐酸有一半作还原剂,还原产物是ClO2;
B.根据氯气和转移电子之间关系式计算;
C.根据方程式知,还原剂和还原产物的物质的量之比为2:2=1:1;
D.氧化剂和气体之间关系式计算.
解答 解:该反应中氯酸钾中Cl元素化合价由+5价变为+4价、浓盐酸中部分Cl元素化合价由-1价变为0价,转移电子数为2,浓盐酸有一半作还原剂,还原产物是ClO2,根据方程式知,还原剂和还原产物的物质的量之比为2:2=1:1,
A.该反应中有一半浓盐酸作还原剂,一半浓盐酸作酸,故A错误;
B.该反应中生成1mol氯气转移电子2mol,则产生0.1mol Cl2时转移电子数目为0.2NA,故B错误;
C.根据以上分析知,还原剂和还原产物的物质的量之比是1:1,故C错误;
D.当有0.2mol氧化剂参与反应时,生成气体的物质的量是0.3mol,标准状况下该反应产生气体的体积=0.3mol×22.4L/mol=6.72L,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,正确判断氧化产物和还原产物是解本题关键,注意:该反应中元素化合价不能出现交叉,即氯酸钾中Cl元素化合价不能变为0价、HCl中Cl元素化合价由-1价变为+4价,为易错点.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| C. | 1000mL0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 质量为32g的O3和O2的混合物中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A3++2B-═2A2++B2 | B. | C2+2B-═2C-+B2 | ||
| C. | 2A2++C2═2A3++2C- | D. | B2+2C-═C2+2B- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3﹒10H2O晶体 | |
| B. | 本实验需用到的仪器是天平、药匙、玻璃棒、烧杯、100mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaOH═Na2SO4+2H2O | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | NH3+HCl═NH4C1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
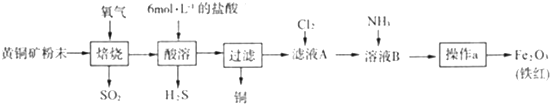
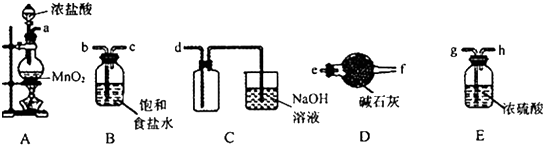
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com