
【题目】一定温度下,无水硫酸铜粉末为受热分解生成CuO和气体A。气体A为SO2、SO3和O2中的一种或几种。请回答:
(1)只用一种试剂就能证明气体A中是否含有SO2,该试剂可以是__________;
a. 石蕊溶液 b. 品红溶液 c. 氯化钡溶液 d. 酸性高锰酸钾溶液
(2)对气体A的合理组成进行如下假设:
①只有SO3一种气体;②只有两种气体;③三种气体都有
若假设②成立,写出无水硫酸铜受热分解的反应方程式___________;
(3)若气体A中SO2、SO3和O2都有,用如图所示装置定量测定经NaOH溶液吸收后剩余气体体积(气体体积最后换算为标准状况)。
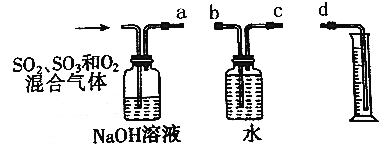
①装置的连接顺序为____________;(用字母表示);
②实验中测定的是_________气体的体积;
③实验发现测定结果比理论值明显偏低,其原因是___________。
【答案】BD 2CuSO4![]() 2CuO+2SO2↑+O2↑ a→c,b→d O2 发生2SO2+O2+4NaOH=2Na2SO4+2H2O,导致氧气被部分吸收,测定结果偏低
2CuO+2SO2↑+O2↑ a→c,b→d O2 发生2SO2+O2+4NaOH=2Na2SO4+2H2O,导致氧气被部分吸收,测定结果偏低
【解析】
(1)二氧化硫具有漂白性和还原性;
(2)假设②成立,则无水硫酸铜粉末受热分解生成CuO、SO2和O2;
(3)实验时,a连接c,b连接d,可测定氧气的体积,用NaOH溶液吸收气体时,可能发生2SO2+O2+4NaOH=2Na2SO4+2H2O,以此解答该题。
(1)二氧化硫具有漂白性和还原性,则可用品红或高锰酸钾溶液检验二氧化硫,故答案为bd;
(2)假设②成立,则无水硫酸铜粉末受热分解生成CuO、SO2和O2,方程式为2CuSO4![]() 2CuO+2SO2↑+O2↑;
2CuO+2SO2↑+O2↑;
(3)①实验时,a连接c,b连接d,可测定氧气的体积,故答案为:a→c,b→d;
②氢氧化钠溶液吸收二氧化硫、三氧化硫,量筒用于测量氧气的体积;
③用NaOH溶液吸收气体时,可能发生反应2SO2+O2+4NaOH=2Na2SO4+2H2O,导致氧气被部分吸收,测定结果比理论值明显偏低。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】取44.2g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为15.9g;另一份溶于水,配成500mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸氢钠的物质的量为_____mol。
(2)所配溶液中Na+的物质的量浓度为______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_________。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层) ![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
(7)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(8) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是
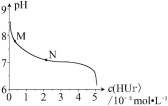
A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)氯气的制取方法有很多,写出实验室用MnO2来制取氯气的离子方程式__________。
(2)工业炼铁通常在___________设备中进行,需要用到铁矿石、焦炭、__________和空气。
(3)氯化铁溶液通常应用于印刷电路板制作,写出其反应的离子方程式___________。
(4)请写出红热的炭与浓硫酸反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医院处方药“复方电解质注射液”可作为水、电解质的补充源,注射液中含有NaCl、MgCl2和KCl三种无机盐,其中![]() 。
。
(1)若实验室药配制该电解质注射液500mL,所需的玻璃仪器有:玻璃板、烧杯和_______,需用托盘天平称量氯化钠固体___________g;
(2)已知该注射液中![]() ,
,![]() ,则
,则![]() ________
________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 1mol甲基含10NA个电子
B. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA
C. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA
D. 15 g C2H6中含有共价键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备下列物质的生产流程合理的是( )
A. 由铝土矿冶炼铝:铝土矿![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. 从海水中提取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. 由NaCl制漂白粉:饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D. 由黄铁矿制硫酸:黄铁矿![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com