
| 离子 | Na+ | Fe2+ | Cl- | SO42- |
| 浓度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
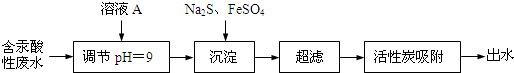
分析 含汞酸性废水加入A后溶液pH增大,应加入碱性物质,可为氢氧化钠溶液,加入硫化钠、硫酸亚铁,可生成HgS、FeS等沉淀,呈过滤,废水可直接排放,结合溶液呈电中性解答(4),以此解答该题.
解答 解:含汞酸性废水加入A后溶液pH增大,应加入碱性物质,可为氢氧化钠溶液,加入硫化钠、硫酸亚铁,可生成HgS、FeS等沉淀,呈过滤,废水可直接排放,
(1)汞为重金属,对人体有害,如直接排放,可引起水污染,故答案为:a b;
(2)由以上分析可知A为氢氧化钠溶液,故答案为:b;
(3)Na2S与Hg2+发生反应的离子方程式是S2-+Hg2+=HgS↓,故答案为:S2-+Hg2+=HgS↓;
(4)该废水经处理后,溶液存在c(Na+)+2c(Fe2+)=c(Cl-)+2c(SO42-),遵循电荷守恒,则c(Fe2+)=$\frac{2.0×1{0}^{-4}+2×2.5×1{0}^{-4}-3.0×1{0}^{-4}}{2}$mol/L=2.0×10-4mol/L,
故答案为:2.0×10-4.
点评 本题综合考查物质的分离、提纯以及离子浓度的计算,为高考常见题型,要求学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
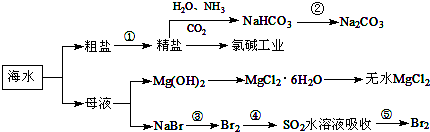
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 g CO2的体积是22.4 L | |
| B. | NH3的摩尔质量是17g/mol | |
| C. | 100 mL 1 mol/L NaCl溶液中含有1 mol Cl- | |
| D. | 标准状况下,11.2 L H2O中含有3.01×1023个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
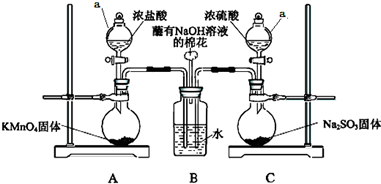 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )| A. | 等浓度的两种酸其酸性相同 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 鞣酸能与Fe3+发生显色反应,而莽草酸不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com