
【题目】下列物质属于非电解质的是
A. 液氯 B. 淀粉 C. 硝酸钾 D. 液态氯化氢
科目:高中化学 来源: 题型:
【题目】19世纪末,英国科学家瑞利在对气体密度(通常在混合气体中,相对分子质量大的气体的体积分数越大,则混合气体的平均密度就越大)进行测定的工作中,发现以不同来源的N2进行测定时,会出现不能消除的微小误差,从而导致了稀有气体的发现。在实验中,瑞利利用了如下图所示的实验系统(箭头表示气体流向),通过的气体经过净化处理的纯氧气或空气。
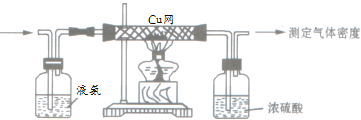
(1)实验中要保证Cu丝始终保持红热,其中发生的化学反应可表示为:___________,2NH3 + 3CuO ![]() N2 + 3Cu + 3H2O。倘若在实验中观察到铜丝变黑,可采用的措施是______________,在此反应过程中铜丝的作用是_________和__________;浓硫酸的作用是吸收多余的氨气和______________。
N2 + 3Cu + 3H2O。倘若在实验中观察到铜丝变黑,可采用的措施是______________,在此反应过程中铜丝的作用是_________和__________;浓硫酸的作用是吸收多余的氨气和______________。
(2)当通过的气体为纯氧时,测得气体的密度为ρ1。
(3)在空气的净化过程中,为除去可能混有的H2S、CO2和水蒸气,可将气体先通过_____________,当净化后的空气通过上述反应系统,在这种情况下测得最终密度ρ2=1.256g·L-1。
(4)当空气直接通过灼热的Cu网,测得气体的密度为ρ3。试ρ1、ρ2、ρ3比较的大小:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250mL 0、1000mol/LNaCl溶液时,下列操作会使配得溶液中NaCl的物质的量浓度偏大的是( )
A.移液后未洗涤烧杯
B.在容量瓶中进行定容时,仰视刻度线
C.在容量瓶中进行定容时,俯视刻度线
D.定容后摇匀,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的数值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.2.4g Mg变为Mg2+时失去的电子数目为0.2NA
C.1 L 1molL﹣1 CH3COONa溶液中存在NA个CH3COO﹣
D.1 mol Cn H2n+2含有(3n+2)NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或实验应该注意的事项)中,主要是从实验安全角度考虑的是( )
A. 实验剩余的药品不能放回原瓶
B. 可燃性气体的验纯
C. 在实验前进行实验装置气密性检查
D. 胶头滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2
CH2===CH2
CH2===CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
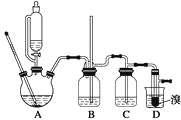
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_________________;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”或“下”);
(5)若产物中有少量未反应的Br2,最好用________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是___________;但又不能过度冷却(如用冰水),其原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com