
V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是 ;写出X、Z两种元素组成的化合物Z2X2的一种用途: 。
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式 。
(3)X、Y、Z三种元素可组成一种强酸U,M在适当条件下被U吸收生成一种盐。该盐的水溶液的pH 7(填“大于”、“小于”或“等于”)。原因是(用离子方程式表示)
(4)若将V金属投入到盐酸中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:
(5)有人设想寻求合适的催化剂和电极材料,以Y2、Z2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 ;放电时溶液中H+移向 (填“正”或“负”)极。
(1)第二周期VA族 绿色氧化剂
(2)3NO2+H2O=2HNO3+NO
(3)< NH4++ H2O?NH3·H2O+H+
(4)2Fe2++2H++H2O2=2Fe3++ 2H2O
(5)N2+6e-+8H+= 2NH4+ 正
解析试题分析:根据题给信息知,V、W、X、Y、Z是原子序数依次递减的五种常见元素。X元素是地壳中含量最多的元素,则X为氧元素;Y、Z组成的气态化合物M的水溶液呈碱性,则M为氨气,Y为氮元素,Z为氢元素;W的单质在X2中燃烧产物可使品红溶液褪色,则W为硫元素;V是一种历史悠久、应用广泛的金属元素,则V为铁元素。(1)Y为氮元素,在周期表中的位置是第二周期VA族;X为氧元素,Z为氢元素,二者组成的化合物H2O2的用途:绿色氧化剂。(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,该反应为二氧化氮与水反应,化学方程式3NO2+H2O=2HNO3+NO。(3)O、N、H三种元素可组成一种强酸HNO3,NH3在适当条件下被HNO3吸收生成一种盐NH4NO3。该盐的水溶液的pH小于7;原因是NH4++ H2O?NH3·H2O+H+;(4)V为铁元素,若将铁投入到盐酸中,生成了浅绿色溶液硝酸亚铁,硝酸亚铁酸性溶液与双氧水反应的离子方程式:2Fe2++2H++H2O2=2Fe3++ 2H2O;(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,该电池的正极电极反应式N2+6e-+8H+= 2NH4+;放电时溶液中H+移向正极。
考点:考查元素推断及相关物质的性质,设计氧化还原反应方程式、离子方程式的书写,燃料电池。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:填空题
(15分)四种主族元素的性质或结构信息如下:
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
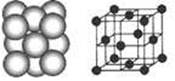
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| A | A的基态原子最外层电子排布式为2s22p3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的气体在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质E的原子结构示意图为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有下列9种微粒: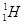 、
、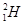 、
、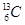 、
、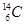 、
、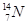 、
、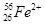 、
、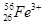 、
、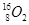 、
、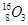 。按要求完成以下各题:
。按要求完成以下各题:
(1) 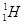 、
、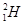 、
、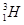 分别是氢元素的一种 ,它们互称为 。
分别是氢元素的一种 ,它们互称为 。
(2)互为同素异形体的微粒是 。
(3)对于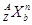 ,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
①Z、n、b相同而A不同: ;
②A、n、b相同而Z不同: ;
③A、Z、b相同而n不同: ;
④Z、n、A相同而b不同: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全满或半满。
(1)写出四种元素的元素符号:
A ;B ;C ;D 。
(2)写出C、D两种元素基态原子的轨道表示式:
C ;
D 。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:
。
(4)写出B元素单质和氢化物的电子式,单质 ,氢化物 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某元素有6个电子处于第三电子层d轨道上,推测该元素的原子序数是________,并根据洪特规则推测在第三电子层d轨道上未成对电子的个数是________个。
Ⅱ.核电荷数小于18的两种元素,A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个,则:
(1)写出元素的名称和符号:A.____________________,B.____________________。
(2)写出各原子的核外电子排布的轨道表示式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com