
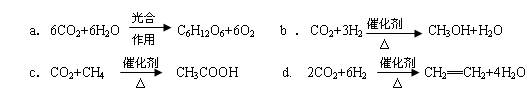
 CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=-49.0kJ/mol
CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=-49.0kJ/mol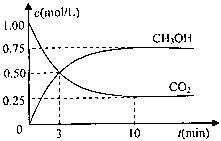
| A�������¶� | B������He��g����ʹ��ϵѹǿ���� |
| C����H2O��g������ϵ�з��� | D���ٳ���1molCO2��3molH2 |
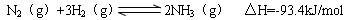

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2(g) ��H��0 ����һ��ʱ��Ը������ڵ����ʽ��з����õ��������ݣ�
2NO2(g) ��H��0 ����һ��ʱ��Ը������ڵ����ʽ��з����õ��������ݣ�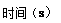  | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| A��������������ͨ��N2O4 | B�������ݻ����䣬ͨ��He |
| C��ʹ�ø�Ч���� | D�������¶� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
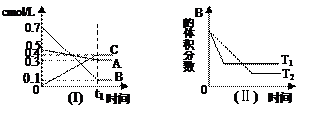 |
 2C(g)
2C(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
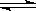 2SO3(g)����֪cʼ(SO2)=0.4mol/L��cʼ(O2)=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=19���жϣ���SO2ת����Ϊ50%ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬����δ�ﵽ�����ĸ�������У���Ҫ��д��������̣�
2SO3(g)����֪cʼ(SO2)=0.4mol/L��cʼ(O2)=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=19���жϣ���SO2ת����Ϊ50%ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬����δ�ﵽ�����ĸ�������У���Ҫ��д��������̣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC��g��+dD��s��������Ӧ����һ��ʱ����A������nmol��B������n��2mol��C������3n��2mol��D������nmol����ʱ�ﵽ��ѧƽ��״̬��������˵����ȷ���� �� ��
cC��g��+dD��s��������Ӧ����һ��ʱ����A������nmol��B������n��2mol��C������3n��2mol��D������nmol����ʱ�ﵽ��ѧƽ��״̬��������˵����ȷ���� �� ��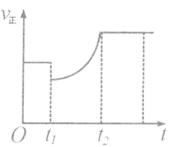
 ����ʱ��ı仯�����t1ʱ�̿����Ǽ�����A��Ũ�ȣ�������C��Ũ��
����ʱ��ı仯�����t1ʱ�̿����Ǽ�����A��Ũ�ȣ�������C��Ũ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 HX��g����ƽ�ⳣ��Ϊ9������2.0 mol
HX��g����ƽ�ⳣ��Ϊ9������2.0 mol| A��9% | B��18% | C��30% | D��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 �ﵽƽ��ʱ������˵������ȷ���ǣ� ��
�ﵽƽ��ʱ������˵������ȷ���ǣ� ��| A��M��N��Q�������ʵ�Ũ��һ����� | B��M��Nȫ�������Q |
| C����Ӧ��������ֵ�Ũ�Ȳ��ٱ仯 | D��ѹǿ���ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0mol S02 | B��1mol S02 | C��2mol S03 | D��0.3mol O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
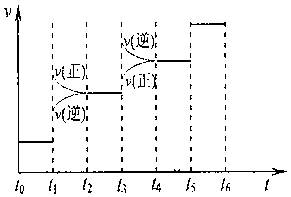
 2C��g����H��0����ȷͼ������ͼ�еģ� ��
2C��g����H��0����ȷͼ������ͼ�еģ� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com