
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. H3PO2溶于水的电离方程式为:H3PO2![]() H++H2PO2-
H++H2PO2-
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O
C. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4
D. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-═O2↑+4H+
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( ) 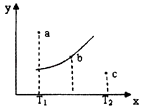
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH-=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)═Mg2+(aq)+2OH﹣(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
A.NaOH
B.NH4Cl
C.MgSO4
D.NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行NaCl溶液蒸发时,一般有以下操作过程,其正确的操作顺序为 ( )
①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热,用余热蒸干
A. ②③④⑤①B. ①②③④⑤C. ②③①④⑤D. ②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述中,正确的是
A.新制氯水中有3种分子,有4种离子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.向新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水不可以使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7瓶有机物A,B,C,D,E,F,G,它们可能是苯、甲苯、己烯、苯酚、乙醇、乙醛、乙酸,为确定每瓶成分,进行下列实验:
①取7种少量有机物,分别加水,振荡后与水分层的是A,D,G;
②取少量A,D,G分别加入溴水,振荡后,只有D能使溴水褪色,且有机层为无色;
③取少量A,G,分别加入酸性KMnO4溶液,振荡后,G能使酸性KMnO4溶液褪色;
④取A少量加入浓H2SO4和浓HNO3 , 加热后倒入水中,有苦杏仁味黄色油状液体生成;
⑤取少量B,C,E,F,分别加入银氨溶液,经水浴加热后,只有B出现银镜;
⑥取少量C,E,F,若分别加入金属钠,均有H2放出;若分别加入Na2CO3溶液,只有F有气体放出;
⑦取少量C,E,滴入浓溴水,E生成白色沉淀;
⑧取少量C,F,混合后加入浓H2SO4 , 加热后有果香味的油状液体生成.
(1)试推断A﹣G各是什么物质?写出它们的分子式.
A , C , F , G .
(2)写出实验⑤反应的化学方程式 .
(3)写出实验⑦反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钒的化合物在水溶液中存在多种离子形式:V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)、VO43-(无色)、V5O143-(红棕色)等。
(1)如果向酸性的VSO4溶液中滴加高锰酸钾溶液,溶液出现的颜色变化是:紫色→绿色(I)→蓝色→绿色(Ⅱ)→黄色。则出现绿色(I)时发生反应的离子方程式是_________________________。
(2)向酸性(VO2)2SO4溶液中加入NaOH溶液调节pH,随着NaOH溶液的加入,溶液先出现红棕色,继续加入NaOH溶液,最终变为无色。写出(VO2)2SO4生成红棕色溶液,红棕色溶液变为无色溶液时发生反应的离子方程式:___________________________________________________________。
(3)向VO2+的溶液中加入氨水可以得到NH4VO3(微溶于水);NH4VO3受热最终会分解生成钒的氧化物。
①室温下,NH4VO3在水中的Ksp曲线如图Ⅰ所示,则其值为________。
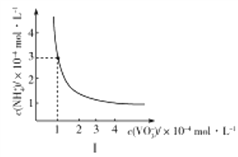
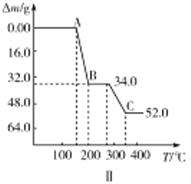
②热重分析可探究化学变化的历程,某研究小组取234gNH4VO3进行探究,焙烧过程中固体质量的减小量随温度的变化曲线如图Ⅱ所示,则B的化学式是__________,C的化学式是__________。
(4)已知2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O。用硫酸酸化的H2C2O4溶液测定(VO2)2SO4溶液中钒含量的步骤为:取10.0mL0.1mol·L-1H2C2O4溶液于锥形瓶中,将待测液盛放在滴定管中;滴定到终点时,消耗待测液的体积为10.0mL.
①是否需要加入指示剂?________________。
②(VO2)2SO4溶液中钒的含量为________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。不仅可以制备物质,还可以提纯和净化。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离了交换膜只允许阳离子通过,请回答以下问题:
①图中A极要连接电源的_______(填“正”或“负”)极
②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出。(选填“a”“b” “c” “d” “e”或“f”)

③电解总反应的离子方程式是_____________。
(2)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示

①电源正极为____(填A或B),阴极反应式为_____________。
②若电解过程中转移了5mol电子,则膜左侧电解液的质量变化为__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com