
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
分析 A、电解质溶液中含有水分子;
B、pH=3的盐酸溶液中,氢离子浓度为10-3mol/L,而pH=1的盐酸溶液中,氢离子浓度为0.1mol/L;
C、一水合氨为弱电解质,不能完全电离;
D、一水合氨为弱电解质,不能完全电离.
解答 解:A、电解质溶液中含有水分子,故强电解质溶液中也一定含分子,故同时含有分子和离子的电解质溶液,不一定是弱电解质溶液,故A错误;
B、pH=3的盐酸溶液中,氢离子浓度为10-3mol/L,而pH=1的盐酸溶液中,氢离子浓度为0.1mol/L,故前者的氢离子浓度是后者的百分之一,故B错误;
C、一水合氨为弱电解质,不能完全电离,故0.1mol/L的KOH溶液中的氢氧根的浓度为0.1mol/L,而0.1mol/L的氨水溶液中氢氧根浓度小于0.1mol/L,故C错误;
D、一水合氨为弱电解质,不能完全电离,故pH=3的硫酸和pH=11的氨水等体积混合后,氨水过量,故溶液显碱性,故pH大于7,故D正确.
故选D.
点评 本题考查了强弱电解质的本质区别和有关离子浓度的计算,难度不大,应注意的是强电解质溶液中无溶质分子,但并不是无分子.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{19}^{40}$ K 和${\;}_{20}^{40}$ Ca | ||
| C. | O2 和 O3 | D. | H2O 和 D2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
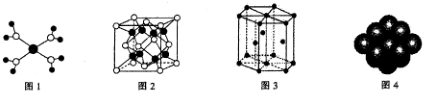
| A. | 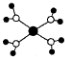 水合铜离子的模型如图所示,1个水合铜离子中含有4个配位键 | |
| B. | 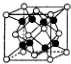 K2O晶体的晶胞如图所示,每个K2O晶胞平均占有8个O2- | |
| C. | 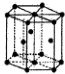 金属Zn中Zn原子堆积模型如图所示,空间利用率为68% | |
| D. |  金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,每个Cu原子的配位数均为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
 (或
(或 、
、 ) .
) .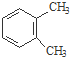 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$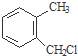 $→_{③}^{NaCN}$
$→_{③}^{NaCN}$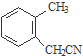 $→_{H_{2}O}^{H_{2}SO_{4}}$
$→_{H_{2}O}^{H_{2}SO_{4}}$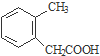
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
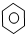 ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
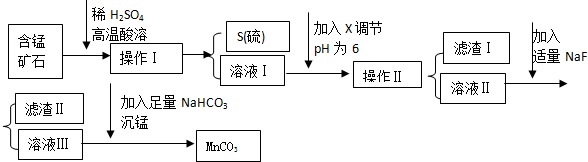
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
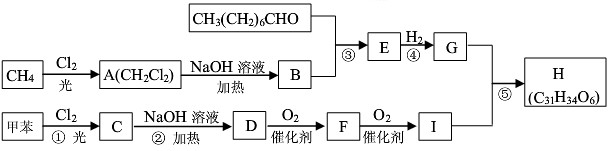
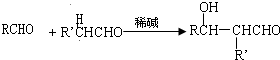
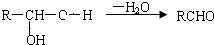
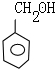 ,E
,E .
. .
.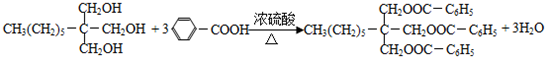 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 由Y、M两种元素组成的化合物是离子化合物 | |
| C. | M的简单气态氢化物的热稳定性比Z的弱 | |
| D. | 原子半径:r(M)<r(W)>r(Z)<r(Y)<r(X) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com