
| A. | 称取无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 容量瓶中原来留有一点蒸馏水,没有干燥 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转、摇匀 |
分析 A.配制溶液时,固体的溶解要在烧杯中进行;
B.容量瓶中有少量蒸馏水,不影响溶液的配制;
C.移液时未用玻璃棒引流,液体溅出,将导致浓度偏小;
D.定容后,塞好瓶塞,反复倒转,摇匀,使溶液均匀.
解答 解:A.配制溶液时,固体的溶解要在烧杯中进行,容量瓶是精密仪器,不能用容量瓶溶解,故A错误;
B.容量瓶中原来存有少量蒸馏水,溶质的物质的量和溶液的体积都不变,配制溶液浓度不变,故B正确;
C.移液时未用玻璃棒引流,液体溅出,导致浓度偏小,故C错误;
D.定容后,塞好瓶塞,反复倒转,摇匀,使溶液均匀,故D正确;
故选AC.
点评 本题考查了配制一定物质的量浓度的溶液操作不当,带来的实验误差分析,本题熟悉配制原理及实验操作步骤是解题关键,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 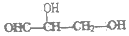 | B. | 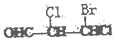 | C. | CH3CH2COOH | D. | 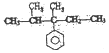 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
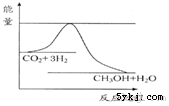 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
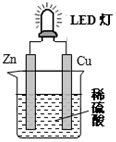
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内H2O(g)、CO、H2物质的量相等 | B. | 容器内气体的密度不再改变 | ||
| C. | 生成n mol CO的同时生成n mol H2 | D. | v正(H2O)=v正(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10 NA | |
| B. | 22.4 LC02中含有共价键数目4 NA | |
| C. | 若H2O2分解产生成0.1mol氧气转移的电子数为0.2 NA | |
| D. | 同温、同压同体积的CO和NO含有的电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com