
| A、原混合物中CuO与Fe2O3物质的量的比为l:l |
| B、反应后所得CO2的质量为8.8g |
| C、参加反应的CO的质量为8.4g |
| D、原混合物中CuO与Fe2O3的质量比为1:1 |
| 40g |
| 100g/mol |
|


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、含有金属阳离子的晶体一定是离子晶体 |
| B、固态和熔融状态可导电,投入水中形成的水溶液也可导电,该物质可能是金属晶体 |
| C、白磷晶体中只存在一种作用力,即分子间作用力 |
D、如图,NaCl晶体中,距离最近的Na+组成的最小多面体是正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、粗盐提纯,选①和② |
| B、用CCl4提取碘水中的碘,选③ |
| C、分离Na2CO3溶液和CH3COOC2H5,选④ |
| D、用NaOH溶液吸收Cl2,选⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2、Na2SO3、FeCl3、KCl |
| B、Na2CO3、NaHCO3、KNO3、NH4Cl |
| C、NH3?H2O、H3PO4、Na2SO4、H2SO4 |
| D、HCl、CH3COOH、C2H5OH、Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷是直链烃,所以分子中3个碳原子也在一条直线上 |
| B、丙烯所有原子均在同一平面上 |
C、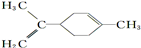 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 |
D、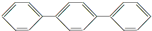 至少有16个原子共平面 至少有16个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com