
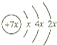 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.分析 A、B、C、D是四种短周期元素,由A的原子结构示意图,可知x=2,则A的原子序数为14,故A为Si元素;A、B、C同周期,即处于第三周期,B是同周期第一电离能最小的元素,故B为Na元素;C的最外层有三个成单电子,最外层电子排布为3s23p3,故C为P元素;C、D同主族,则D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图,可知x=2,则A的原子序数为14,故A为Si元素;A、B、C同周期,即处于第三周期,B是同周期第一电离能最小的元素,故B为Na元素;C的最外层有三个成单电子,最外层电子排布为3s23p3,故C为P元素;C、D同主族,则D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
(1)由上述分析可知,B为Na元素、C为P元素,故答案为:Na;P;
(2)D为N元素,处于第二周期,同周期自左而右,第一电离能呈增大趋势(个别除外),所以第二周期第一电离能最大的元素是F,周期自左而右电负性增大,故电负性最大的元素是F,故答案为:F;F;
(3)E为Fe元素,外围电子排布式为3d64s2,处于周期表中d区,故答案为:d;
(4)A为Si元素,晶体中最小的环为6个硅原子,故答案为:6.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,注意熟练掌握元素周期律,(4)为易错点,需要学生熟记中学常见的晶胞结构.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,3-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,2-二氯丙烷 | D. | 2,2-二氯丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
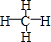 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
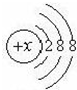 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com