
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
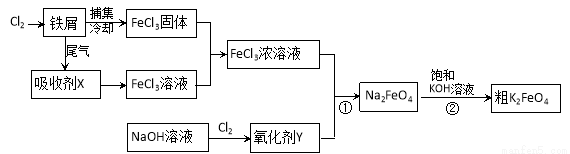
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4 在水溶液中易发生反应:4FeO42?+10H2O 4Fe(OH)3+8OH?+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH?+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42?+CrO2? +2H2O CrO42?+Fe(OH)3↓+OH?
CrO42?+Fe(OH)3↓+OH?
②2CrO42?+2H+ Cr2O72?+H2O
Cr2O72?+H2O
③Cr2O72 ?+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
(1)① Fe3+ + 3H2O  Fe(OH)3(胶体) + 3H+(2分)
Fe(OH)3(胶体) + 3H+(2分)
② 2Fe3+ + Cu=2Fe2+ + Cu2+(2分)(2)FeCl2 ;NaClO(各1分)
(3)2Fe3++3ClO-+10OH-=2FeO42 -+3Cl-+5H2O(2分)
(4)K2FeO4溶解度小,析出晶体,促进反应进行(2分)(5)B(2分)(6)63.1%(2分)
【解析】
试题分析:(1)铁离子水解生成氢氧化铁胶体具有吸附性可以作净水剂,其原理可表示为Fe3+ + 3H2O  Fe(OH)3(胶体) + 3H+。
Fe(OH)3(胶体) + 3H+。
②铁离子具有氧化性,能氧化金属铜,则用FeCl3溶液(32%~35%)腐蚀铜印刷线路板的原理可表示为2Fe3+ + Cu=2Fe2+ + Cu2+。
(2)吸收剂X能吸收尾气氯气生成氯化铁溶液,因此X应该是氯化亚铁,化学式为FeCl2。氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,则能氧化氯化铁的是次氯酸钠,化学式为NaClO。
(3)反应①是利用次氯酸钠氧化氯化铁制备高铁酸钠,根据电子得失守恒以及原子守恒可知,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42 -+3Cl-+5H2O。
(4)要发生复分解反应则必须满足有挥发性物质或难电离物质或难溶性物质,因此根据方程式2KOH+Na2FeO4=K2FeO4+2NaOH可知,该反应之所以能发生是由于K2FeO4溶解度小,析出晶体,促进反应进行。
(5)根据方程式4FeO42?+10H2O 4Fe(OH)3+8OH?+3O2↑可知,提纯K2FeO4应该抑制该反应,所以最好的试剂是稀KOH溶液(抑制平衡)、异丙醇(减小溶解),答案选B。
4Fe(OH)3+8OH?+3O2↑可知,提纯K2FeO4应该抑制该反应,所以最好的试剂是稀KOH溶液(抑制平衡)、异丙醇(减小溶解),答案选B。
(6)根据反应①②③可知
FeO42?~~~~~6Fe2+
1mol 3mol
n 0.1000 mol/L×0.01893L
解得n=6.31×10-4mol
则上述样品中高铁酸钾的质量分数=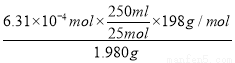 ×100%=63.1%
×100%=63.1%
考点:考查氯化铁的性质、用途以及高碳酸盐制备的有关判断与含量计算


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关叙述正确的是
A.氢键是一种特殊化学键,它广泛地存在于自然界中
B.在CH3—CHOH—COOH分子中含有1个手性C原子
C.碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D.含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:选择题
已知HCO3―+AlO2― +H2O=CO32― +Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为
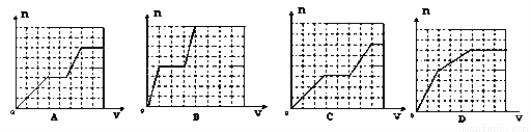
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
有机物F的合成路线如图所示:
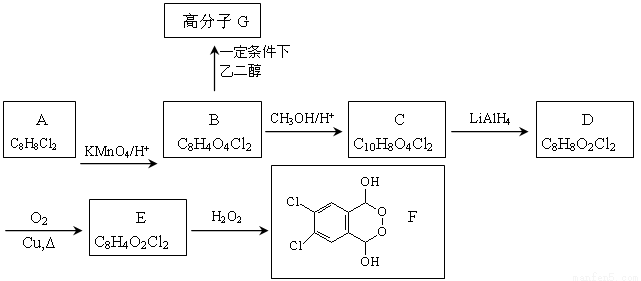
已知以下信息:
(1)RCOOR’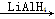 RCH2OH
RCH2OH
(2)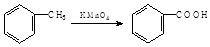
回答以下问题:
(1)A的结构简式为 ,G的结构简式为 。
(2)B生成C的化学方程式为 。
(3)检验E中含氧官能团的试剂是 ,现象是 。
(4)E→F的反应类型是 。
(5)A的同分异构体中,符合下列条件的同分异构体有 种(不包含A),写出其中一种的结构简式 。
①属于芳香族化合物
②苯环上有四个取代基
③苯环上的一溴取代物只有一种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为
A.5 B.4 C.3 D.2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
25℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得
c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
B | 浓硫酸具有酸性和吸水性 | 浓硫酸可使PH试纸先变红后变黑 |
C | Cl2和SO2均有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
D | C的还原性小于Si | 可用焦炭和石英在高温下反应制取粗硅和CO |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:选择题
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com