
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色,说明产生的气体为乙烯 |
分析 A.氯水中的次氯酸能漂白pH试纸;
B.液体加热要加沸石或碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应该采取停止加热,待溶液冷却后重新添加碎瓷片;
C.硫酸钡和AgCl均为不溶于酸的白色沉淀;
D.挥发出的乙醇也能够使酸性高锰酸钾溶液褪色,干扰了检验结果.
解答 解:A.氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH值,故A错误;
B.液体加热要加沸石或碎瓷片,引入汽化中心,可防止溶液暴沸,如果加热一段时间后发现忘记加碎瓷片,应该采取停止加热,待溶液冷却后重新添加碎瓷片,故B正确;
C.硫酸钡和AgCl均为不溶于酸的白色沉淀,则向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失,溶液中可能含Ag+,故C错误;
D.溴乙烷与NaOH乙醇溶液共热产生的乙烯中混有乙醇,应该除去乙醇,否则乙醇也能够使KMnO4酸性溶液褪色,干扰了检验,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、蒸馏、pH试纸的使用方法等知识,明确化学实验基本操作方法为解答关键,注意掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 现代建筑的门框架,常用古铜色的硬铝制造,硬铝含有的元素是Al、Cu、Mg等 | |
| C. | 金属在自然界中一般以化合态存在,越活泼的金属越难冶炼 | |
| D. | 日常生活中应用的金属材料一般为合金,合金的熔点一般比组分金属高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐之间发生的反应一定属于复分解反应 | |
| B. | AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 | |
| C. | 根据分散系是否具有丁达尔现象可将分散系分为溶液、胶体和浊液 | |
| D. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Cl2+H2O═HCl+HClO | |
| C. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
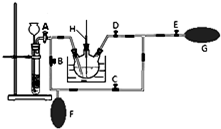 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
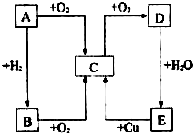 如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答:
如图所示,A、B、C、D、E五种物质的相互转化关系,B能使紫色石蕊试纸变蓝.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 常温常压下,48gO2和O3混合气含有的氧原子数为3NA | |
| D. | 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均约为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )| A. | 该实验表明化学能可以转化为热能 | |
| B. | NaOH溶液的浓度大于1.00 mol•L-1 | |
| C. | V=50 mL时,混合液呈碱性 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com