
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
分析 根据c(酸)=$\frac{c(标准)•V(标准)}{V(待测)}$分析滴定过程中产生的误差,若标准液浓度被或消耗标准液体积偏小,滴定结果偏低,否则偏高,据此进行解答.
解答 解:A.配制标准溶液的NaOH中混有Na2CO3杂质,以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏大,根据c(酸)=$\frac{c(标准)•V(标准)}{V(待测)}$分析,可知c(酸)偏高,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,则测定结果偏低,故B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,不会影响测定结果,故C错误;
D.滴定过程中不小心将液体从锥形瓶溅出,导致消耗标准液体积偏小,测定结果偏低,故D错误;
故选A.
点评 本题考查中和滴定中的误差分析,题目难度不大,若标准溶液的体积偏小,测得的物质的量的浓度也偏小;若标准溶液的体积偏大,则测得的物质的量的浓度也偏大,试题培养了学生的分析能力及化学实验能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | X.Y形成的最简单化合物的稳定性:X>Y | |
| B. | Z位于元素周期表的第三周期第IA族 | |
| C. | Q与R两元素组成的分子构型是正四面体型 | |
| D. | X、Y最多可以形成5种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | (CH3)3COH | C. | CH3CH(OH)CH2CH3 | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
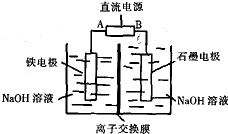 高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:
高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-向正极定向移动 | |
| B. | 电池的总反应是:2C4H10+13O2═8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-+2H2O═4OH- | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
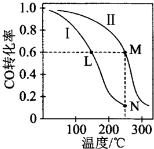
| A. | 该反应的△H>0 | |
| B. | N点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1 mol CH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 当a>b时,c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | 当a<b时,c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 当a与b为任意比时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
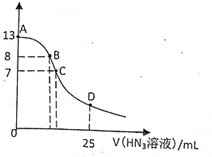
| A. | 水电离出的c(H+):A点小于B点 | |
| B. | 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5 mL | |
| D. | 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)<c(OH-)的溶液一定显碱性 | B. | pH=6的溶液一定显酸性 | ||
| C. | pH=7的溶液一定显中性 | D. | Kw只适用于纯水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com