
【题目】下列物质能促进水的电离的是
A.碳酸钠 B.醋酸 C.乙醇 D.氯化钠
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)![]() N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )
N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在任何条件下,纯水显中性,这是因为
A.pH=7 B.c(H +)=c(OH -)
C.c(H+)=c(OH-)=10-7mol·L-1 D.c(H +)×c(OH-)=10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】椰树牌天然矿泉水的成分:含钠46.31g/L 、含钙35.11g/L 、含碘0.051g/L……,这里所标成分钠、钙、碘指的是
A. 元素 B. 单质 C. 原子 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm﹣3。下列说法错误的是
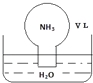
A.水最终会充满整个烧瓶
B.所得溶液的物质的量浓度为 ![]() mol·L﹣1
mol·L﹣1
C.所得溶液的质量分数为![]() ρ
ρ
D.所得溶液中,n(NH3·H2O)+n(NH4+)=![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
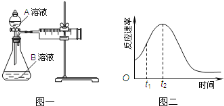
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用浓盐酸和二氧化锰反应制取氯气时,反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
MnCl2+Cl2↑+2H2O收集到7.1g氯气,求:
①发生反应的二氧化锰的物质的量是多少?
②被氧化的氯化氢的物质的量是多少?
(2)把5.1g镁铝合金粉末放入500mL 1mol/L盐酸中,恰好完全反应。试计算:
①该合金中镁和铝的物质的量各为多少mol。
②将等质量的该合金投入足量的氢氧化钠溶液中,求标况下放出气体的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为 ,H为 。
(2)A的电子式为 。
(3)写出B+C→D的化学方程式 。
写出E+G→F的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
B.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.向KHSO4溶液中滴入Ba(OH)2溶液恰好中性:SO42-+H++Ba2++OH-=BaSO4↓+H2O
D.向沸水中滴入饱和氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com