

 Na2S4+3NaBr
Na2S4+3NaBr 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑; Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,
Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,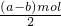 ,故生成氯气的体积=
,故生成氯气的体积=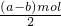 ×22.4L/mol=11.2(a-b)L,
×22.4L/mol=11.2(a-b)L, Na2S4+3NaBr可知,左侧S22-放电生成S42-
Na2S4+3NaBr可知,左侧S22-放电生成S42-

科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第6讲 化学反应速率和化学平衡练习卷(解析版) 题型:选择题
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g)  4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
A.增大反应体系的压强,反应速率可能加快
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝
D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期第三次验收考试化学试卷(解析版) 题型:实验题
无水氯化铝是一种重要的有机合成催化剂,还可用于金属冶炼、润滑油合成;食品级无水氯化铝也可用作膨松剂、絮凝剂等。
某研究性学习小组查阅资料后利用下图所示装置制备无水氯化铝。
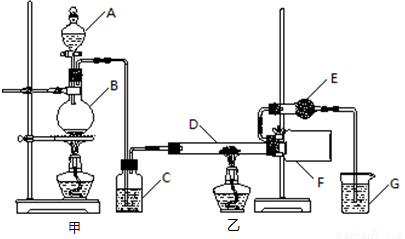
资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃升华,其蒸气是缔合分子(Al2Cl6),在空气中能吸收水分,发生水解。
(1)填写下列仪器的名称:A ,B 。
(2)装置C中盛装的试剂是 ;装置G中盛装的试剂是 。
(3)相同条件下,氯化铝蒸气对氢气的相对密度是 。
(4)装置F中的现象是 。
(5)装置E的作用是 。
(6)实验结束后应先撤去 (填“甲”或“乙”)处的酒精灯。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:实验题
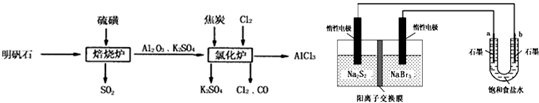
无水氯化铝是一种重要的化工原料,利用明矾石 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下:
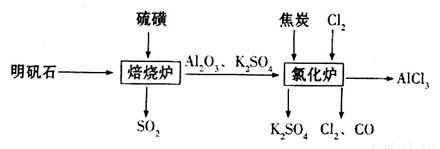
(1)验证焙烧炉产生的气体含有 的方法是________________________________。
的方法是________________________________。
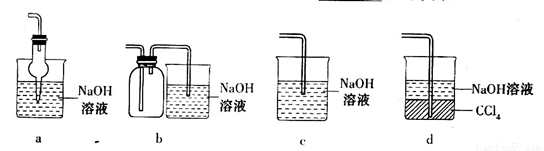
(2)吸收焙烧炉中产生的 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。
(3)氯化炉中发生反应的化学方程式为_________________________________________。
(4)生产氯化铝的过程中产生 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
__________________________________________________________________________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。

①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com