

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
分析 (1)根据废钒催化剂的组成及表中数据判断滤液主要成分;
(2)由题意和流程图可知反应①的目的,将V2O5 转化为可溶性的VOSO4,便于分离提纯;
(3)KClO3为氧化剂,可被还原生成氯离子;
(4)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3;
(5)铝与五氧化二钒反应生成钒与氧化铝.
解答 解:(1)废钒催化剂中含有V2O5、VOSO4及不溶性残渣,由于V2O5为难溶物,所以滤液中含钒的主要成分为VOSO4,
故答案为:VOSO4 ;
(2)反应①的目的是把难溶的五氧化二钒还原为溶于水的VOSO4,该反应的离子方程式为:V2O5+SO32-+4H+═VO2++SO42-+2H2O,
故答案为:V2O5+SO32-+4H+═VO2++SO42-+2H2O;
(3)KClO3为氧化剂,化合价由+5价降低到-1价,则1mo1KClO3参加反应,电子转移的数目为6mol,故答案为:6mol;
(4)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为:NH4++VO3-=NH4VO3↓,根据图2判断最佳温度为沉淀率最高的,应为80℃.
故答案为:NH4++VO3-=NH4VO3↓;80℃;
(5)铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,故答案为:3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
点评 本题考查了金属的回收与资源保护、铝热反应原理等知识,为高频考点,侧重于学生的分析、实验能力的考查,题目难度中等,正确分析、理解工业流程是解题关键,注意明确铝热反应原理.


科目:高中化学 来源: 题型:选择题
 如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:
如图所示,在盛有水的烧杯中倒置一支试管,底部有一枚铁钉,放置数天后观察:| A. | 铁钉生锈,铁钉的腐蚀属于电化学腐蚀腐蚀 | |
| B. | 若试管内液面上升,则铁钉发生的是吸氧腐蚀 | |
| C. | 若试管内液面上升,则铁钉发生的是析氢腐蚀 | |
| D. | 若试管内液面下降,则铁钉发生的是析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1molgL-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 加苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| D. | 通足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
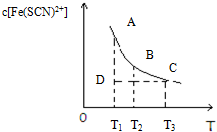 氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq)?Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq)?Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )| A. | FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)3+(aq)△H>0 | |
| B. | 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 反应处于D点时,一定有V正>V逆 | |
| D. | A点与B点相比,A点的c(Fe3)+大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1=-57.3kJ/mol是强酸和强碱在稀溶液中反应生成可溶性盐的中和热 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol | B. | 0.045mol | C. | 0.06mol | D. | 0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生红褐色沉淀 | |
| D. | 滴加KSCN溶液,溶液呈红色,再加足量铁粉红色消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com