
��֪��Ӧ����101 kPaʱ��2C(s)+O2(g)=2CO(g) ��H = -221 kJ��mol-1 ����ϡ��Һ�У�H+(aq)+OH-(aq) =H2O(l) ��H = -57.3 kJ��mol-1���ɴ˿����ƶ����н�����ȷ����
A��ϡ������ϡ��ˮ��Һ��Ӧ����1 molˮ���ų�57.3 kJ����
B���ٵ��ʱ�Ϊ221 kJ��mol-1
C��Ũ������ϡNaOH��Һ��ȫ��Ӧ����1 molˮʱ����Ϊ57.3 kJ
D��1mol̼��ȫȼ�շų����ȴ���110.5 kJ
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016������ӳ��и����ϵ�����¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
����̼ѭ����������ȫ����ĸ߶����ӣ�����CO2��һ�ַ����ǣ�
CO2(g)��3H2(g)  CH3OH(g)��H2O(g) ��H
CH3OH(g)��H2O(g) ��H
��1��500��ʱ���ݻ�Ϊ2L���ܱ������г���2mol CO2��6mol H2�����CO2��CH3OH�����ʵ�����ʱ��仯��ͼ��ʾ��
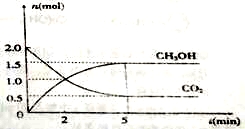
�ٷ�Ӧ�Ħ�S �������������0���ӷ�Ӧ��ʼ��ƽ�⣬H2��ƽ����Ӧ���ʣ�
��(H2)��__________mol/(L��s)��
�ڸ÷�Ӧ��ƽ�ⳣ��K=__________��������λ��Ч���֣���ƽ��ʱH2��ת����Ϊ________��
�۽�����ƽ����ϵ���¶�������700�棬ƽ�ⳣ��K=5.01����H 0�������������������Ϊ�˼ӿ컯ѧ��Ӧ������ʹ��ϵ����������ʵ������٣�������������ʱ���ɲ�ȡ�Ĵ�ʩ�� __________������ţ���
a�������¶� b����С�������ݻ� c��ʹ�ú��ʵĴ��� d���ٳ���CO2����
��2����֪����H2O(g)��H2O(l) ��H����44.0 kJ��mol-1
��2CO(g)��O2(g)��2CO2(g) ��H����566.0 kJ��mol-1
��2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(g) ��H����1257.5 kJ��mol-1
д��Һ̬�״�����ȫȼ������CO�����Һ̬H2O���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����������ָ�������д����������( )
A����c(HCO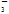 )��0.1 mol��L��1����Һ�У�NH
)��0.1 mol��L��1����Һ�У�NH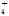 ��AlO
��AlO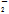 ��Cl����NO
��Cl����NO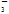
B������ˮ�������c(H��)��1��10��12 mol��L��1����Һ�У�Fe2����ClO����Na����SO
C���ڼ������۲���H2����Һ�У�SO ��NO
��NO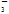 ��Na����NH
��Na����NH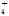
D����ʹ��ɫʯ����ֽ��������Һ�У�SO ��CO
��CO ��Na����K��
��Na����K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ�����и�һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ҹ��Ŵ��ļ���Ӧ���У��乤��ԭ�����漰��ѧ��Ӧ����
A����ҩʹ�� | B����ʳ��� | C��ת������ | D������ұ�� |
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������·�����Ӧ3A(g)+2B(g)  zC(g)+2D(g)����2 L ���ܱ������а� 4 mol A �� 2 mol B ��ϣ�2 min ��Ӧ�ﵽƽ��ʱ���� 1.6 mol C���ֲ�÷�Ӧ����v(D)=0.2 mol��(L��min) -1 ��������˵������ȷ����
zC(g)+2D(g)����2 L ���ܱ������а� 4 mol A �� 2 mol B ��ϣ�2 min ��Ӧ�ﵽƽ��ʱ���� 1.6 mol C���ֲ�÷�Ӧ����v(D)=0.2 mol��(L��min) -1 ��������˵������ȷ����
A��z=4 B��B ��ת������40%
C��A ��ƽ��Ũ����1.4 mol��L-1 D��ƽ��ʱ����ѹǿ��ԭ��ѹǿ��0.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�Ű��и߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
X��Y��Z��W��Q��R���ֶ���������Ԫ�أ�ԭ��������������Z��̬ԭ�Ӻ���������δ�ɶԵ��ӣ�Y��Z��W�ֱ���X�γɳ���������ķ��ӽṹ����Ϊ�������塢�����κ�V�Σ�Q�ĸ������������±���W��R��ͬ��Ԫ�ء�
Q | I1 | I2 | I3 | I4 | I5 | �� |
������(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | �� |
�ش������й����⣺
��1��Wԭ�ӵļ۵����Ų�ͼΪ______________________��
��2��������X 2W2�ĵ���ʽ_________��������XYZ�Ľṹʽ__________��
��3����ͬ�����£�YW2��RW2������ˮ�е��ܽ�Ƚϴ���� ��д����ʽ����ԭ���� ��
��4��RW3�����еļ���___________��RW32-���ӵ����幹����_______________�Ρ�
��5��X��Z��W������Ԫ�����γɵij������ӻ�����Ļ�ѧʽΪ ��YW2�еĻ�ѧ������Ϊ ���ۼ�������ԡ��Ǽ��ԡ��������ݵȵ���ԭ����ָ����YW��Ϊ�ȵ������Һ���Zԭ�ӵ����� (Ҫ��дһ�ּ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�Ű��и߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У���ȷ����
A��1s�����ƽ���ͼ��һ�����棬�������е�ÿ��С�ڵ����һ������
B��NaH�еĦҼ���������ԭ�ӵ�s��p����ԡ�ͷ��ͷ����ʽ�ص��γɵ�
C��������ɽṹ���Ƶķ��ӣ�һ������Է�������Խ���ۡ��е�Խ��
D�����ִ���ѧ�У�������ԭ�ӹ����ϵ���������������Ԫ�أ���Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�����и�һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�εĻ�����к���0��2mol Na����0��4mol Mg2����0��4mol Cl������SO42��Ϊ
A��0��1mol B��0��5mol C��0��3mol D��0��15mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���в����У�һ������Ҫ���ȵ���
A����ȡ B�� ���� C�� ���� D�� �ܽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com