
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | |
| C. | 草酸使高锰酸钾溶液褪色:5H2C2O4+2MnO4-+6H+═2Mn2++10 CO2↑+8H2O | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH${\;}_{4}^{+}$+2Ag↓+3NH3+H2O |
分析 A.乙酸为弱酸,所以不可以“拆”成离子;
B.氢氧化铜为难溶物,离子方程式中氢氧化铜需要保留化学式;
C.酸性高锰酸钾溶液具有强氧化性,能够将草酸氧化成二氧化碳;
D.乙醛分子中含有醛基,能够与银氨溶液发生银镜反应.
解答 解:A.乙酸与碳酸钠溶液反应生成乙酸钠、二氧化碳气体和水,乙酸不能拆开,正确的离子方程式为:2CH3COOH+CO32-═CO2↑+H2O+CH3COO-,故A错误;
B.醋酸溶液与新制氢氧化铜反应,氢氧化铜不能拆开,正确的离子方程式为:2CH3COOH+Cu(OH)2→2CH3COO-+2H2O+Cu2+,故B错误;
C.草酸使高锰酸钾溶液褪色,反应的离子方程式为:5H2C2O4+2MnO4-+6H+═2Mn2++10 CO2↑+8H2O,故C正确;
D.乙醛溶液与足量的银氨溶液共热发生银镜反应,反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH4++2Ag↓+3NH3+H2O,故D正确;
故选CD.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
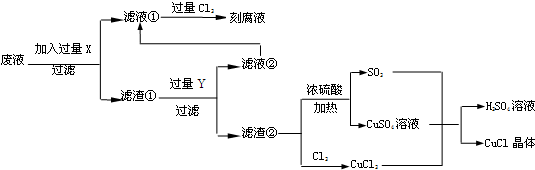
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
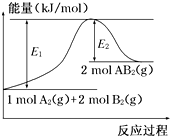 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气光照条件下反应,反应类型为取代反应;乙烯可以使溴水褪色,发生加成反应 | |
| B. | 不能用酸性高锰酸钾溶液鉴别乙酸和乙醇 | |
| C. | 乙醇在铜做催化剂并加热条件下生成乙醛,发生催化氧化反应 | |
| D. | 生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
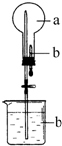 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | CH4、Cl2混合气和饱和食盐水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com