
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.分析 (1)与C同主族的元素Ge位于第四周期IVA族,根据能量最低原理书写核外电子排布式;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,同主族自上而下第一电离能减小;
(3)CN-与氮气分子互为等电子体,CN-中C原子与N原子之间形成3对共用电子对、含有1对孤对电子,杂化轨道数目为2;
(4)Na[Au(CN)2]中的配离子为[Au(CN)2]+,该配离子中形成2个配位键、CN-中形成1个三键,离子中含有4个σ键;
(5)以体心Na+研究,与之相邻的CN-位于面心,晶胞中Na+与CN-之间的距离为a cm,则晶胞棱长为2a cm,计算晶胞体积,根据均摊法计算晶胞中晶胞中Na+、CN-离子数目,再表示出晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)与C同主族的元素Ge位于第四周期IVA族,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s24p2,
故答案为:1s22s22p63s23p63d104s24p2;
(2)同周期随原子序数增大元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,Na、C、N的第一电离能由大到小的顺序为:N>C>Na,
故答案为:N>C>Na;
(3)CN-与氮气分子互为等电子体,与N2分子具有相同空间构型和键合形式,CN-中C原子与N原子之间形成3对共用电子对、含有1对孤对电子,杂化轨道数目为2,C原子采取sp杂化,
故答案为:sp;N2;
(4)Na[Au(CN)2]中的配离子为[Au(CN)2]+,该配离子中形成2个配位键、CN-中形成1个三键,离子中含有4个σ键,0.1mol配离子中含有的σ键数为0.4NA,
故答案为:[Au(CN)2]+;0.4NA;
(5)以体心Na+研究,与之相邻的CN-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与CN-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4、CN-离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{49}{{N}_{A}}$g,则晶胞密度为4×$\frac{49}{{N}_{A}}$g÷(2a cm)3=$\frac{49}{2{a}^{3}{N}_{A}}$g.cm-3,
故答案为:6;$\frac{49}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式、等电子体、配合物、晶胞结构与计算等,注意同周期第一电离能异常情况,掌握均摊法进行晶胞有关计算,难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应过程中有离子键、非极性键、极性键的断裂和形成 | |
| B. | 1molNH4+中含有的共用电子对为3mol | |
| C. | N2属于单质,不存在化学键 | |
| D. | 离子化合物中一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | 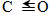 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
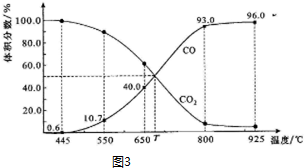
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com