

分析 (1)N2(g)+3H2(g)=2NH3(g)△H=-92.40kJ•mol-1 ①
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-86.98kJ•mol-1 ②
根据盖斯定律将①+②计算可得;
(2)①根据在985℃时,H2S的转化率为40%,即可求出H2S的物质的量的该变量,然后根据在反应中,物质的量的该变量之比等于计量数之比,即可求出S2的物质的量的该变量,然后根据v=$\frac{\frac{△n}{V}}{△t}$来计算反应速率.
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热,据此判断;
(3)①采取控制变量法分析,由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,反应为气体体积增大的反应,增大压强平衡向体积减小的方向移动;
②依据化学平衡三段式列式计算平衡浓度结合平衡常数概念计算得到.
解答 解:(1)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.40kJ•mol-1 ①
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-86.98kJ•mol-1 ②
将①+②可得:
N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=(-92.4KJ/mol)+(-86.98KJ/mol)=-179.38KJ/mol,
故答案为:N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-179.38KJ/mol.
(2)①在985℃时,H2S的转化率为40%,H2S的物质的量的该变量△n=3.5mol×40%=1.4mol,在反应中,物质的量的该变量之比等于计量数之比,故S2的物质的量的该变量△n=0.7mol,故反应速率v(S2)=v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.7mol}{2L}}{7min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热,故反应S2(g)+2H2(g)=2H2S(g)放热,即△H<0,故答案为:<;
(3)①由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,平衡向正反应方向移动,反应为气体体积增大的反应,增大压强平衡向体积减小的方向移动,即P1<P2;故答案为:<;
②100℃时,将3mol CH4和4mol H2O通入容积为100L的恒容密闭容器中,CO(g)和H2O(g))的浓度相同,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.03 0.04 0 0
变化量(mol/L) 0.02 0.02 0.02 0.06
平衡量(mol/L) 0.01 0.02 0.02 0.06
平衡常数K=$\frac{c(CO)c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})c(H{\;}_{2}O)}$=$\frac{0.02×0.06{\;}^{3}}{0.01×0.02}$=0.0216;
故答案为:0.0216.
点评 本题考查了利用盖斯定律来解题和反应速率的求算、平衡的计算以及利用温度对平衡转化率的影响来分析反应吸热还是放热等,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-氯戊烷的分子式为C5H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷能发生取代反应 | D. | 3-氯戊烷的同分异构体共有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁是第IIA族元素 | |
| B. | 第IA族元素全部是金属元素 | |
| C. | 氧族中含金属元素 | |
| D. | 第3周期中既有金属元素又有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋中含有的醋酸 | B. | 酒中含有的酒精 | ||
| C. | 葡萄中含有的葡萄糖 | D. | 谷类中含有的淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
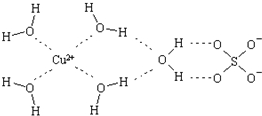 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com