
分析 (1)KAl(SO4)2为强电解质,在水中完全电离;
(2)金属Na和水反应生成氢氧化钠和氢气;
(3)二者反应生成硝酸银、一氧化氮和水;
(4)氯化铵与氢氧化钙加热生成氯化钙、水和氨气;
(5)氯化铁与铜反应生成氯化亚铁与氯化铜.
解答 解:(1)KAl(SO4)2为强电解质,在水中完全电离,离子方程式:KAl(SO4)2=K++Al3++2SO42-;
故答案为:KAl(SO4)2=K++Al3++2SO42-;
(2)金属Na和水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O═2Na++2OH-+H2↑;
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)二者反应生成硝酸银、一氧化氮和水,化学方程式:3Ag+4HNO3=3AgNO3+NO↑+2H2O;
故答案为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;
(4)氯化铵与氢氧化钙加热生成氯化钙、水和氨气,方程式Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
(5)氯化铁与铜反应生成氯化亚铁与氯化铜,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+.
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质是解题关键,注意化学反应遵循客观事实,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
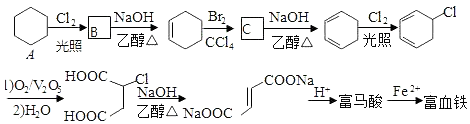
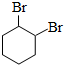 .
. ,其中含有的官能团名称为:羧基和碳碳双键.
,其中含有的官能团名称为:羧基和碳碳双键. +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaCl+H2O.
+NaCl+H2O.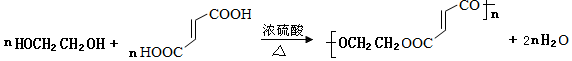 .
.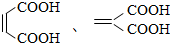 (写 出结构简式).
(写 出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有两个氢原子的酸一定是二元酸 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | Na2O、Na2O2组成元素相同,与CO2反应产物相同 | |
| D. | 钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A. | 生石灰具有吸水性 | 生石灰用作袋装食品的抗氧化剂 |
| B. | 碳酸钠能与盐酸反应 | 碳酸钠可用作治疗胃酸过多的药剂 |
| C. | 氢氟酸能与硅酸钠反应生成硅酸 | 氢氟酸可用于雕刻玻璃 |
| D. | Al2O3熔点非常高 | 氧化铝用作耐高温材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 mL 1 mol•L-1 Na2CO3溶液中含有的阴离子数大于0.1NA | |
| B. | 常温常压下,28g14CO和N2的混合物所含的质子数为14NA | |
| C. | 将NA个NH3分子溶于1L水中得到1 mol•L-1的氨水 | |
| D. | 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化和干馏的过程都没有涉及化学变化 | |
| B. | 石油分馏产品中重油进行催化裂化,可提高汽油等轻质油的产量和质量 | |
| C. | 天然气和沼气的主要成分相同,都是甲烷 | |
| D. | 氢气的热值比汽油高,是理想的清洁燃料和绿色能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气是氧化产物 | |
| B. | O2F2是氧化剂 | |
| C. | 若生成 4.48 L HF,则转移 0.8 mol 电子 | |
| D. | 还原剂与氧化剂的物质的量之比为 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 | 钢铁闸门与锌块在海水中构成原电池,钢铁闸门作正极 |
| B | 某些抗氧化剂作食品添加剂 | 抗氧化剂与食品反应,延缓食品腐败速率 |
| C | 用热的烧碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| D | 明矾可作漂白剂 | 明矾电离出的Al3+水解时产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl3+2KI=2FeCl2+2KCl+I2 | B. | 6FeCl2+3Br2═4FeCl3+2FeBr3 | ||
| C. | FeBr2+Cl2═FeCl2+Br2 | D. | FeI2+Cl2═FeCl2+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com