
【题目】【化学——选修5:有机化学基础】
D是一种催眠药,F是一种香料,它们的合成路线如下:
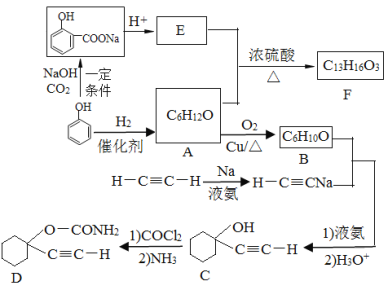
(1)A的化学名称是______,C中含氧官能团的名称为______。
(2)F的结构简式为______,A和E生成F的反应类型为______。
(3)A生成B的化学方程式为_______________。
(4)B与乙炔钠合成C的反应类型(酸化前)是_________;写出由C合成D的第二个反应的化学方程式___________________________________。
(5)同时满足下列条件的E的同分异构体有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
【答案】
(1)环己醇(1分) 羟基(1分)
(2)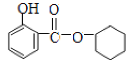 (2分) 酯化(取代)反应(1分)
(2分) 酯化(取代)反应(1分)
(3)2![]() +O2
+O2![]() 2
2![]() +2H2O(2分)
+2H2O(2分)
(4)加成反应(1分) 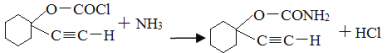 (2分)
(2分)
(5)9(2分)
(6) (3分)
(3分)
【解析】
试题分析:
(1)苯酚和氢气发生加成反应生成A,根据A的分子式可知A是环己醇,A发生催化氧化生成B,B 是环己酮,根据C的结构简式可知C分子中含有的含氧官能团是羟基。
(2) 经酸化生成E,则E的结构简式为
经酸化生成E,则E的结构简式为 ,E和A发生酯化反应生成F,F的结构简式为
,E和A发生酯化反应生成F,F的结构简式为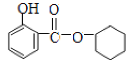 。
。
(3)根据以上分析可知A生成B的化学方程式为2![]() +O2
+O2![]() 2
2![]() +2H2O。
+2H2O。
(4)B与乙炔钠合成C的反应类型(酸化前)是羰基的加成反应;由C合成D的第二个反应是氯原子被氨基取代,反应的化学方程式为![]() 。
。
(5)①遇FeCl3溶液发生显色反应,含有酚羟基;②能发生银镜反应,含有醛基。如果苯环上含有2个取代基,应该是—OH和—OOCH,有邻间对三种;如果含有3个取代基,应该是2个—OH和—CHO,有6种结构,共计9种同分异构体。
(6)合成1,3-丁二烯需要制备1,4-丁二醇,根据题干信息可知合成路线为
 。
。


科目:高中化学 来源: 题型:
【题目】【实验化学】
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中受热时易分解,溶于水后生成NaHSO3。实验室制备少量Na2S2O5的方法:控制反应温度在40℃左右,在不断搅拌下向Na2CO3过饱和溶液中通入SO2,实验装置如图所示:

当溶液pH约为4时,停止反应。在20℃左右静置结晶得到Na2S2O5晶体。
(1)当溶液pH约为4时,溶液中含硫元素的物质主要为 (填化学式)。该反应中SO2与Na2CO3溶液反应的离子方程式为 。
(2)有同学认为该实验存在缺陷,该缺陷会导致实验过程及实验结束后 。
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是 、吸滤瓶和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用无水乙醇洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ氢、碳、氮都是重要的非金属元素,它们的单质及其化合物在科学研究和工业生产中有重要的应用。
(1)下列微粒基态的电子排布中未成对电子数最多的是__(填序号)
a.N3- b.Fe3+ c.Cu d.Cr e.C
(2)第一电离能介于B、N之间的第二周期元素有_____种。
(3)已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出该二聚体的结构式:____________________________。
(4)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN
[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为____。1 mol HCHO分子中含有σ键的物质的量为____mol。
②HOCH2CN分子中碳原子轨道的杂化类型是__。与H2O分子互为等电子体的阴离子为__。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为______。
Ⅱ.由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14∶4∶5∶1∶1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6ns1,回答下列问题。
(1)该配位化合物X的化学式为________。
(2)元素B、C、D的第一电离能由小到大排列顺序为________。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可任意比互溶,解释其主要原因为_______________________。
(5)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1∶1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素在地壳中含量丰富,下列有关说法不正确的是
A. 不锈钢属于铁合金B. 用KSCN溶液可检验溶液中的Fe3+
C. 铁制品腐蚀过程中铁被还原D. 铁矿石炼铁过程中涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构及性质如下表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等; |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是______________;
(2)Z元素在周期表中的位置是__________________;
(3)X、Y、Z三元素的最高价氧化物对应水化物的酸性,由强到弱的顺序是(用化学式表示)_________________;
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是:(用离子方程式表示)_______________________________;
(5)写出Z的单质与二氧化硫的混合气体通入水中的离子反应方程式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期律进行推断,下列不正确的是( )
A.碱性:KOH>NaOH
B.氧化性:Cl2>S
C.稳定性:HBr>HI
D.酸性:H3PO4>HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入盐酸酸化的![]()
![]() 溶液产生白色沉淀,说明有
溶液产生白色沉淀,说明有![]()
![]() 存在
存在
B. 溶液呈黄绿色,且有刺激性气味,说明有![]()
![]() 分子存在
分子存在
C. 加入有色布条,一会儿有色布条褪色,说明溶液中有![]()
![]() 存在
存在
D. 加入![]()
![]() 溶液,氯水黄绿色消失,说明有
溶液,氯水黄绿色消失,说明有![]()
![]() 分子存在
分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾是一种重要的光敏材料和有机反应的催化剂,化学式为K3[Fe(C2O4)3]·3H2O,为翠绿色晶体,溶于水,难溶于乙醇。110℃下失去三分子结晶水,230℃时分解。该配合物对光敏感,光照下即发生分解。
Ⅰ、三草酸合铁酸钾的制备
①溶解:在托盘天平上称取4.0gFeSO4·7H2O晶体,放入250mL烧杯中,加入1 mol·L-1 H2SO4 1mL,再加入H2O 15mL,加热使其溶解。
②沉淀:在上述溶液中加入1 mol·L-1H2C2O4 20mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾斜法倒出清液,洗涤该沉淀3次以除去可溶性杂质。
③氧化:在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20mL,不断搅拌溶液并维持温度在40℃左右,使Fe2+充分氧化为Fe3+。滴加完后,加热溶液至沸腾以除去过量的H2O2。
④生成配合物:保持上述沉淀近沸状态,趁热滴加1 mol·L1 H2C2O4使沉淀溶解至呈现翠绿色为止。冷却后,加入15 mL 95%的乙醇水溶液,在暗处放置,结晶。减压过滤,抽干后用少量乙醇洗涤产品,继续抽干,称量,计算产率,并将晶体放在干燥器内避光保存。
Ⅱ、产物中C2O42-的质量分数的测定
称取0.20g产品于锥形瓶中微热溶解并加入2 mL稀硫酸,趁热用0.0200 mol·L-1 KMnO4标准溶液滴定至终点,重复操作2次,平均消耗KMnO4溶液的体积为25.00mL。计算产物中C2O42-的质量分数。
请回答下列问题:
(1)步骤①溶解时应加入少量的稀硫酸,目的是 。
(2)步骤②要维持微沸几分钟,但FeC2O4·2H2O晶体易暴沸,则适宜采取的加热方式是 。
(3)生成的FeC2O4·2H2O晶体上易沾附硫酸盐,如何证明晶体已洗涤干净 。
(4)步骤③需保持恒温40℃,原因是 。
(5)用乙醇洗涤的作用是 。
(6)滴定终点的现象是 ,通过计算,产物中C2O42-的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com