
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
分析 A.当a=5mL时,溶液中溶质为等物质的量浓度的Na2C2O4、NaCl、NaHC2O4,溶液中存在电荷守恒,根据电荷守恒判断;
B.当a=10mL时,二者恰好完全反应生成等物质的量浓度的NaHC2O4、NaCl,溶液中存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断;
C.当a=15时,反应得到H2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在物料守恒;
D.当a=20时,反应得到H2C2O4、NaCl的混合溶液,且氯化钠浓度是草酸的2倍.
解答 解:A.当a=5时反应得到等物质的量浓度的Na2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(Cl-)+2c(C2O42-),c(H2C2O4)≠c(HC2O4-)+c(Cl-),故A错误;
B.当a=10时反应得到NaHC2O4溶液、NaCl溶液的混合溶液,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(Cl-)+2c(C2O42-),物料守恒2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-)=c(Na+),带入计算得到c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故B正确;
C.当a=15时反应得到H2C2O4溶液、NaHC2O4溶液、NaCl溶液的混合溶液,溶液中存在物料守恒,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04mol•L-1,故C正确;
D.当a=20时反应得到H2C2O4溶液、NaCl溶液的混合溶液,且氯化钠是草酸的2倍,草酸是二元弱酸分步电离c(Na+)>c(H+),故D错误;
故选BC.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确反应原理、混合溶液中溶质成分及各成分物质的量关系是解本题关键,注意溶液中存在的电荷守恒和物料守恒,侧重考查学生分析判断及计算能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
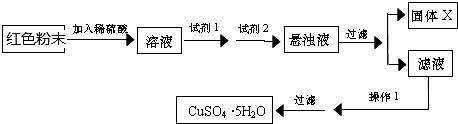
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-═CH3COO-+H2O | B. | H++OH-═H2O | ||
| C. | CH3COOH+OH-+Na+═CH3COONa+H2O | D. | CH3COOH+NaOH═CH3COO-+Na++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com