
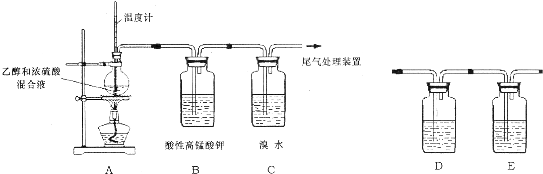
分析 装置A:乙醇在浓硫酸的催化作用下、加热170℃发生分子内脱水生成乙烯,温度计测反应的温度,装置B:乙烯与酸性高锰酸钾溶液发生氧化还原反应使高锰酸钾溶液褪色,装置C:乙烯含有碳碳双键,能和溴发生加成反应,为进一步验证使酸性高锰酸钾溶液褪色的是乙烯,在A、B间增加下列D、E装置,溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,所以可以测定溴水反应前后后溶液pH变化:若PH值变大,则为加成反应,若PH值变小则为取代反应.
(1)乙醇在浓硫酸的催化作用下、加热170℃发生分子内脱水生成乙烯;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水;
②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,据此解答;
(4)①依据浓硫酸在反应中起催化剂作用判断解答;
②A.反应焓变与反应物生成物状态有关,与催化剂无关;
B.依据催化剂对反应速率的影响;
C.使用催化剂能够降低反应的活化能;
D.平衡常数只与温度有关.
解答 解:(1)乙醇在浓硫酸的催化作用下170℃时发生分子内脱水生成乙烯,反应的化学方程式为:CH3CH2OH$→_{△}^{170℃}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{△}^{170℃}$CH2=CH2↑+H2O;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水,化学方程式:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
故答案为:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰,二氧化硫为酸性氧化物,能够被氢氧化钠溶液吸收,然后用品红溶液检验二氧化硫是否除尽,再通入酸性的高锰酸钾溶液,所以D中盛装的试剂是氢氧化钠,E中盛装的试剂是品红溶液;
故答案为:a;c;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,所以可以测定溴水反应前后后溶液pH变化:若PH值变大,则为加成反应,若PH值变小则为取代反应;
故答案为:测定反应前后溴水的PH值,若PH值变大,则为加成反应,若PH值变小则为取代反应;
(4)①浓硫酸在乙醇消去生成乙烯的反应中起催化剂作用,所以反应后生成产物为乙烯和硫酸,反应方程式:烯的生成:CH3CH2++HSO4-→CH2=CH2↑+H2SO4;
故答案为:CH3CH2+;HSO4-;H2SO4;
②A.反应焓变与反应物生成物状态有关,与催化剂无关,所以使用浓硫酸不会改变反应焓变,故A错误;
B.催化剂能够加快反应速率,故B正确;
C.使用催化剂能够降低反应的活化能,使 更多分子变为活化分子,加快反应速率,故C正确;
D.平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选:BC.
点评 本题以乙烯的实验室制备和性质检验载体考查了乙醇消去反应,明确反应原理及乙烯的性质是解题关键,注意催化剂对反应速率的影响,注意平衡常数只与温度有关,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 若a<b,则c<$\frac{1}{2}$(a+b) | B. | 若a<b,则c>$\frac{1}{2}$(a+b) | C. | 若a>b,则c=$\frac{1}{2}$(a+b) | D. | 若a=b,则c=$\frac{1}{2}$(a+b) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 燃料电池的正极反应式为:O2+2H2O+4e-=4OH- | |
| B. | 装置中NaOH溶液的作用是吸收产生的有毒气体氯气 | |
| C. | 装置中的电子流动路径为:负极→外电路→阴极→苦卤水→阳极→正极 | |
| D. | 理论上,当b 极周围产生2g H2,电池消耗C6H12O6的质量为15g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
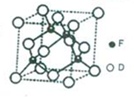 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其分子中的原子都在一条直线上 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
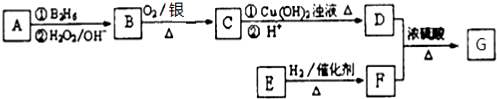
 :
: ;
; ;
;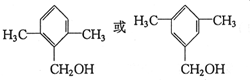 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com