
【题目】下列变化中,需加氧化剂才能实现的是
A. Cl2 →NaClO B. H2O2 → O2 C. (NH4)2SO4 →N2 D. CaO→CaCl2
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述不正确的是
A. R的气态氢化物为H2R B. R的最高价氧化物的水化物为H2RO4
C. R一定是第IVA族元素 D. R的最高价氧化物为RO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的化学式分别为H2XO3、H3YO4、H2ZO4,下列说法正确的是
A. 气态氢化物的稳定性:XH4>YH3>H2Z;
B. 元素非金属性强弱关系:X>Y>Z
C. 最高价氧化物对应水化物酸性:H2XO3>H3YO4>H2ZO4
D. 原子半径:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质所用试剂和方法均正确的是
A.乙酸乙酯(乙酸):饱和碳酸钠溶液、分液
B.苯(环己烯):溴水、分液
C.苯(苯酚):溴水、过滤
D.乙烷(乙烯):酸性高锰酸钾溶液、洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F是一种橡胶,具有高弹性、耐寒性和耐磨损性能,X是一种合成树脂,二者的工业合成路线如下图所示。

已知:I.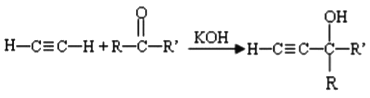
II.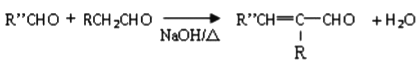
(-R、-R′、-R′′表示可能相同或可能不同的原子或原子团)
(1)①反应的类型为_______。
(2)E的系统命名为________,其分子中最多有______个原子共平面。
(3)A分子中核磁共振氢谱的吸收峰只有1组,C的结构简式为_______。
(4)关于D的说法不正确的是______。
a.分子式为C5H12O
b.可被氧化成醛类
c.官能团含有碳碳双键和羟基
d.能够发生加成、消去、取代、聚合等反应
(5)H存在顺反异构,其反式结构简式为_____, H的同分异构体中属于芳香族化合物的共有_______种。
(6)B与FeCl3溶液作用显紫色。B与G在一定条件下反应生成X的化学方程式为________。
(7)已知: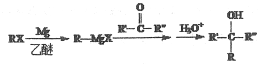 (R、R′、R′′代表烃基或氢)
(R、R′、R′′代表烃基或氢)
结合本题信息,以乙醇为原料,无机试剂任选,写出合成CH3CH=CHCH(OH)CH2CH3的路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 用少量水稀释0.1 mol/L氨水时,溶液中![]() 减小
减小
B. 将Na2CO3溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 0.1 mol/L Na2CO3与0.1 mol/L NaHCO3溶液等体积混合:
3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D. 0.1 mol/L的NaOH溶液和0.2mol/L的NH4Cl溶液等体积混合后:
c(OH-)-c(H+)=c(Na+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:___________________________。
(2)图2中,钢闸门C作________极。若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为_____________________________________,检测该电极反应产物的方法是_________________________________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________极(填“正”或“负”)。F电极上的电极反应式为_______________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因:___________________________________________________。
(4)乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_____________________________________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟
B. 该反应利用了Cl2的强氧化性
C. 该反应中HCl是氧化产物
D. 生成1molN2有6mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com