
| 反应速率v | 平衡常数K | 平衡转化率α |
分析 (1)将方程式$\frac{3(①-②)-③}{2}$得Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),焓变进行相应的改变;
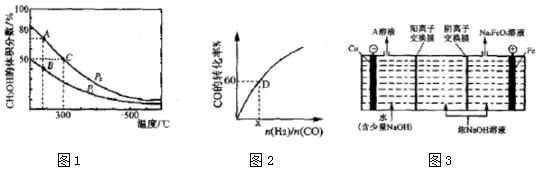
(2)①该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,则甲醇含量增大,根据图知,比较A和B点知,相同温度、不同压强下,A点甲醇体积分数大于B点,说明压强P2>P1,压强越大、温度越高,化学反应速率越快;
化学平衡常数只与温度有关,根据图知,温度越高,甲醇含量越低,说明平衡逆向移动,则正反应是放热反应,温度越高,化学平衡常数越小;
甲醇的含量越大,则反应物转化率越大;
②先计算该点化学平衡常数K,再计算浓度商,根据化学平衡常数K与浓度商的相对大小确定反应方向;
③设n(H2)=amol、n(CO)=bmol,氢气的转化率为40%、CO的转化率为60%,根据方程式知,参加反应的n(CO)为参加反应的n(H2)的一半,所以40%amol=2bmol×60%,据此计算x值;
(3)Fe3+完全沉淀时c(OH-)3=$\frac{{K}_{sp}[Fe(OH)_{3}]}{4×1{0}^{-5}}$;Cu2+沉淀时c(OH-)2=$\frac{{K}_{sp}[Cu(OH)_{2}]}{c(C{u}^{2+})}$,从而确定需要控制溶液的pH范围;
(4)Cu电极是阴极,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,浓NaOH溶液中钠离子通过阳离子交换膜进入阴极室;阳极上Fe失电子和OH-反应生成Na2FeO4.
解答 解:(1)将方程式$\frac{3(①-②)-③}{2}$得Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),
△H=$\frac{3(△{H}_{1}-△{H}_{2})-△{H}_{3}}{2}$=$\frac{3(-393.5-172.5)-(-1651.0)}{2}$kJ/mol=-23.5 kJ.mol-1,
故答案为:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5 kJ.mol-1;
(2)①该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,则甲醇含量增大,根据图知,比较A和B点知,相同温度、不同压强下,A点甲醇体积分数大于B点,说明压强P2>P1,压强越大、温度越高,化学反应速率越快,A、C压强相同且大于B点压强,温度C点最高,所以反应速率最快的是C点;
化学平衡常数只与温度有关,根据图知,温度越高,甲醇含量越低,说明平衡逆向移动,则正反应是放热反应,温度越高,化学平衡常数越小,C点温度高于A和B点且AB点温度相同,所以化学平衡常数最大的是AB;
甲醇的含量越大,则反应物转化率越大,所以甲醇转化率最大的是A点;
故答案为:C;AB;A;
②C点甲醇的体积分数为50%,即甲醇的物质的量分数为50%,设反应掉的n(CO)=xmol,
CO(g)+2H2(g)?CH3OH
1mol 2mol 0
xmol 2xmol xmol
(1-x)mol 2(1-x)mol xmol
$\frac{xmol}{(1-x)mol+2(1-x)mol+xmol}$×100%=50%
x=0.75
设容器体积为1L,则平衡时c(CH3OH)=0.75mol/L、c(CO)=0.25mol/L、c(H2)=0.50mol/L,化学平衡常数K=$\frac{0.75}{0.25×0.5{0}^{2}}$=12,
向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,此时c(CH3OH)=1mol/L、c(CO)=0.50mol/L、c(H2)=1mol/L,浓度商=$\frac{1}{0.50×{1}^{1}}$=2<K,则平衡正向移动,
故答案为:正反应;
③设n(H2)=amol、n(CO)=bmol,氢气的转化率为40%、CO的转化率为60%,根据方程式知,参加反应的n(CO)为参加反应的n(H2)的一半,所以40%amol=2bmol×60%,x=3,
故答案为:3;
(3)Fe3+完全沉淀时c(OH-)3=$\frac{{K}_{sp}[Fe(OH)_{3}]}{4×1{0}^{-5}}$=$\frac{4×1{0}^{-38}}{4×1{0}^{-5}}$(mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=$\frac{{K}_{sp}[Cu(OH)_{2}]}{c(C{u}^{2+})}$(mol/L)2=$\frac{2.6×1{0}^{-19}}{0.26}$(mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,
故答案为:3≤pH<5;
(4)Cu电极是阴极,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,浓NaOH溶液中钠离子通过阳离子交换膜进入阴极室,所以阴极室溶液中溶质为NaOH;阳极上Fe失电子和OH-反应生成Na2FeO4,电极反应式为,
故答案为:NaOH; Fe-6e-+8OH-=FeO42-+4H2O.
点评 本题考查化学平衡计算、难溶物溶解平衡计算及电化学等知识点,侧重考查学生分析、判断及计算能力,明确化学反应原理是解本题关键,难点是计算(3)题pH值,注意确定范围方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
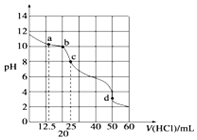 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com