
25°C时,弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是 ( )
A.等物质的量浓度的各溶液的pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN与b mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力增大
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源:2014年高考化学苏教版总复习10-1化学实验常用仪器和基本操作练习卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是( )
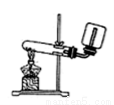
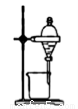


A.实验室制取并收集NH3B.用乙醇提取溴水中的溴C.检查装置气密性D.利用排空气法收集CO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
“绿色化学”对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的“原子经济性”反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,“原子经济性”最好的是(反应均在一定条件下进行)( )
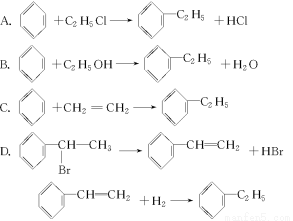
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
A.加MgSO4 B.加HCl溶液 C.加NaOH D.加少量水
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合,下列有关混合溶液的说法一定不正确的是 ( )
A.a<b时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
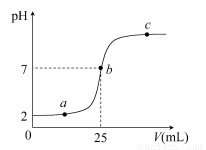
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
有0.1 mol/L的盐酸溶液(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是________(填字母代号,下同);三种酸的pH由大到小的顺序是________。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是________。(不考虑Zn的纯度及表面积等因素)
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液体积由大到小的顺序是________。
(5)三种酸分别跟50 mL 0.1 mol/L的NaOH溶液反应后,溶液的pH由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是 ( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com